
| A. | 对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值 | |
| B. | 在NH3•H2O和NH4Cl浓度均为0.1 mol•L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 | |
| C. | 在NaH2PO4水溶液中存在关系:c(H3PO4)+c(H+)=c(HPO42-)+c(PO43-)+c(OH-) | |
| D. | 沉淀溶解平衡AgI?Ag++I- 的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质 |
分析 A.电离平衡常数越大,则该酸的酸性越强,稀释时溶液pH变化越大;
B.在NH3•H2O和NH4Cl浓度均为0.1 mol•L-1的体系形成了缓冲溶液,则加入少量酸或碱溶液对溶液的pH影响不大;
C.根据溶液中的物料守恒和电荷守恒分析;
D.该平衡为溶解平衡,不是电离平衡.
解答 解:A.对于相同浓度的弱酸HX和HY溶液,前者的Ka较小,则HY的酸性较强,加水稀释相同倍数时,酸性越强,则pH变化越大,所以HY溶液的pH改变值大于HX溶液的pH改变值,故A正确;
B.在NH3•H2O和NH4Cl浓度均为0.1 mol•L-1的体系为缓冲溶液,外加少量酸或碱时,溶液中平衡基本不变,则溶液的pH可保持基本不变,故B正确;
C.溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),还存在物料守恒:c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4),二者结合可得:c(H3PO4)+c(H+)=c(HPO42-)+2c(PO43-)+c(OH-),故C错误;
D.沉淀溶解平衡AgI?Ag++I-,只能说明AgI在溶液中存在溶解平衡,与电离程度大小无关,而AgI溶于水的部分完全电离,属于强电解质,故D正确;
故选C.
点评 本题考查了弱电解质的电离平衡、难溶物的溶解平衡、离子浓度大小比较等知识,题目难度中等,注意掌握影响电离平衡的因素,注意掌握电荷守恒、物料守恒的含义及应用方法.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
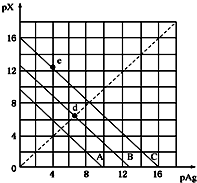 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解 | |
| B. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
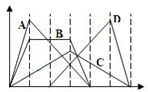 图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A. | 向NaAlO2溶液中逐渐滴入HCl至过量 | |
| B. | 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 | |
| C. | 向澄清石灰水中通入CO2至过量 | |
| D. | 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 g 2H218O中含有的质子数为10NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA | |
| C. | 0.1 mol/L的NaF溶液中所含F-的数目小于0.1NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去0.5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散系的稳定性将其分为胶体、溶液和浊液 | |
| B. | 根据化合物在溶液中能否电离将其分为强电解质和弱电解质 | |
| C. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸和多元酸 | |
| D. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组设计了如图所示的甲醇燃料电池装置.
某实验小组设计了如图所示的甲醇燃料电池装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com