
| O | 2- 4 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
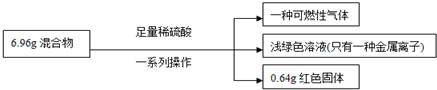
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用铜钥匙做阳极,碳棒做阴极,CuSO4溶液做电解质溶液 |
| B、Zn与铜钥匙用导线相连插入ZnSO4溶液中 |
| C、Zn做阳极,铜钥匙做阴极,ZnSO4溶液做电镀液电解 |
| D、在电镀过程中溶液中的Zn2+浓度减小,Cu2+浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2 |
| B、氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
| C、高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 |
| D、SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol |
| B、0.2mol |
| C、0.2mol<x<0.4mol |
| D、<0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com