
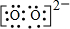 ,所以过氧化钠的电子式为
,所以过氧化钠的电子式为 ;Ba原子最外层2个电子,其电子式为:
;Ba原子最外层2个电子,其电子式为: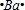 ,
, ;
;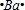 ;
;
 ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、增大压强,可使活化分子数增多,反应速率加快 |
| B、增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C、能够发生有效碰撞的分子一定是活化分子 |
| D、升高温度,使单位体积内活化分子百分数大大增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.2 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b |
| B、若a=b,则容器中一定使用了催化剂 |
| C、若保持温度、压强不变,充入惰性气体,则有a<b |
| D、若其他条件不变,升高温度,则有a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3+H2O=H2SO4 | ||||
B、NH4Cl
| ||||
| C、2Na+2H2O=2NaOH+H2↑ | ||||
| D、NaOH+HNO3=NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | ①往试管中滴入几滴 |
②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com