
【题目】用加热的方法可以分离的一组物质是( )
A. 氯化铵和消石灰B. 碳酸氢铵和过氧化钠
C. 氯化铵和氯化钠D. 碘和氯化铵
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气.
氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如图1:
回答下列问题:
(1)仪器A的名称为 , 甲中活性炭的作用是 , B中加入的药品是 . 实验时从仪器C中放出溶液的操作方法是 .
(2)装置丁中发生反应的离子方程式为 . 用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,图2中可选用的发生装置是(填写字母).
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 , 分离产物的方法是 .
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为 . 为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸衍生物A,其分子式为C6H12O2,实验表明A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化和加热的条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能的结构有
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各化合物中,能发生酯化、加成、消去、氧化、还原五种反应的是( )
A.CH3﹣CH═CH﹣CHO
B.![]()
C.HOCH2﹣CH2﹣CH═CH﹣CHO
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及化学知识,下列叙述正确的是( )
A.棉花的主要成分是纤维素
B.过多食用糖类物质如淀粉等不会致人发胖
C.淀粉在人体内直接水解生成葡萄糖,供人体组织的营养需要
D.纤维素在人体消化过程中起重要作用,纤维素可以作为人类的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
①NaHCO3溶液加水稀释, ![]() 的比值保持增大
的比值保持增大
②浓度均为0.1molL﹣1的Na2CO3、NaHCO3混合溶液:2c(Na+)═3[c(CO ![]() )+c(HCO
)+c(HCO ![]() )]
)]
③在0.1molL﹣1氨水中滴加0.1molL﹣1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH﹣)=10﹣amolL﹣1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO ![]() )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH﹣)+c(H2S)+c(HS)
A.①④
B.②⑤
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.光导纤维、醋酸纤维、玻璃纤维、纤维素等的主要成分都是糖类
B.淀粉、纤维素的分子式都是(C6H10O5)n , 二者互为同分异构体
C.乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生砖红色沉淀
D.纤维素和淀粉遇碘水均显蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫、碳的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1△H1<0 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2△H2<0 (Ⅱ)
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应(II)达到平衡.测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1 , NO的转化率α1= . 其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag﹣ZSM﹣5为催化剂,测得NO转化为N2的转化率随温度变化的情况如图1.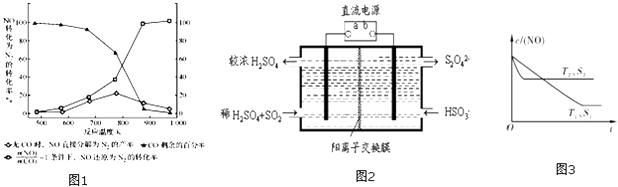
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为;在 ![]() =1的条件下,应控制的最佳温度在左右.
=1的条件下,应控制的最佳温度在左右.
②NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 . 已知NO2﹣的水解常数K=2×10﹣11molL﹣1 , 常温下某NaNO2和 HNO2 混合溶液的PH为5,则混合溶液中c(NO2﹣)和c(HNO2)的比值为
(4)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 阳极的电极反应式为在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO42﹣生成.该反应的离子方程式为
(5)消除汽车尾气,可以通过反应2NO(g)+2CO(g)2CO2(g)+N2(g).当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图3表示在其他条件不变时,NO的浓度c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.①该反应的△H(填“>”或“<”)0.
②若催化剂的表面积S1>S2 , 在右图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注).
(6)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀.查阅资料得知常温下BaSO3的KSP为5.48×10﹣7 , 饱和亚硫酸中c(SO32﹣)=6.3×10﹣8 molL﹣1 . 将0.1molL﹣1的BaCl2溶液滴入饱和亚硫酸中,(填“能”或“不能”)生成BaSO3沉淀,原因是(请写出必要的推断过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积的某营养液两份,其配方如下表:
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
(1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
(2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
比较两份营养液中各种离子的浓度,下列有关说法正确的是( )
A.各种离子的浓度均相同
B.只有c(K+)相同
C.各种离子的浓度均不同
D.只有c(Zn2+)相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com