
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A. 当混合气体平均相对分子质量为26时说明该反应已达平衡
B. 达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大
C. 根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D. 因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在高温下自发进行
【答案】A
【解析】
A项,该反应两种气体的物质的量始终为2:1,平均相对分子质量M=![]() =26,故不管是否达到平衡状态,平均相对分子质量不变,故A项错误;
=26,故不管是否达到平衡状态,平均相对分子质量不变,故A项错误;
B项,平衡后,压缩容器体积,相当于增大压强,反应逆向移动,氨基甲酸铵固体的质量增加,故B项正确;
C项,根据反应方程式,生成物的浓度之比为2:1,故c(NH3)=1.6×10-3mol/L,c(CO2)=0.8×10-3mol/L,15.0 ℃的分解平衡常数为K=c2(NH3)![]() c(CO2)=
c(CO2)=![]() 0.8×10-3=2.0×10-9,故C项正确;
0.8×10-3=2.0×10-9,故C项正确;
D项,该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在高温下自发进行,故D项正确。
故答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列图中的实验,能达到实验目的的是( )
A.  证明稳定性:Na2CO3>NaHCO3
证明稳定性:Na2CO3>NaHCO3
B.  证明非金属性:Cl>Br>I
证明非金属性:Cl>Br>I
C.  验证镁和盐酸反应的热效应
验证镁和盐酸反应的热效应
D. 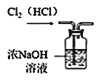 除去 Cl2 中的杂质气体 HCl
除去 Cl2 中的杂质气体 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃的分子式为C10H14,它不能使溴水褪色,可使酸性KMnO4溶液褪色,分子结构中只含有一个侧链,符合条件的烃有( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的1L容器中,反应A(s)+2B(g)![]() C(g)+D(g)的K=1,当加入一定量反应物A和B,下列哪些物理量不再发生变化时己达到平衡状态的是
C(g)+D(g)的K=1,当加入一定量反应物A和B,下列哪些物理量不再发生变化时己达到平衡状态的是
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦B、C、D的分子数之比为1 : 1 : 1
A. ①③④⑤ B. ①③④⑤ C. ①②③④⑤⑦ D. ②③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应
B. 根据图示,物质A为CO2
C. 为增强污水的导电能力,可向污水中加入适量乙醇
D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是

A.a为正极
B.左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+
C.若右池产生0.672L气体(标况下),则转移电子0.15mol
D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种可充电的锂离子电池充、放电的工作 示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入墨形成的复合材料),正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)下列有关说法正确的是( )

A. 该电池的反应式为:Li1-xMnO2+LixC6![]() LiMnO2+C6
LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充电或放电过程中都只存在一种形式的能量转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为我国目前的能源消费结构图:
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤碳为主,但直接燃烧煤炭的弊端是____。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:


根据以上数据,写出该反应的热化学方程式_________________;
(3)甲醇是重要的化学工业基础原料和清洁液体燃料。将煤液化将克服直接将煤作为燃料的不足。其反应原理为CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①在适当的催化剂作用下,该反应能自发进行。则该反应ΔH______0(填“>”、“<”或“=”)
②在体积一定的密闭容器中发生该反应,达到平衡后升高温度,下列说法正确的是______。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
③下列叙述能说明此反应达到平衡状态的是_______。(填字母)
a.混合气体的平均相对分子质量保持不变 b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等 d.混合气体的密度保持不变
④在相同起始温度(500℃)、起始体积相同(2L)的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
反应Ⅱ:恒温恒压 | 0 min | 1 | 3 | 1 | 1 |
反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
查阅资料发现500℃时该反应的平衡常数为2.5。则反应Ⅰ在10min时v正______v逆,则反应均达到平衡时,反应Ⅰ、Ⅱ对比H2的百分含量关系w%Ⅰ(H2)______w%Ⅱ(H2),反应Ⅰ、Ⅲ对比:平衡时CH3OH的浓度c(I)_______c(Ⅲ)(本小题均用“>”、“<”或“=”填空)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:



已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式_____;恒压滴液漏斗支管的作用_____,两水槽中的水为__________(填“热水”或“冷水”).
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是_____;
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:_________________。
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是_____________。
②如何判断 K2FeO4 晶体已经洗涤干净________________。
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为___________。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是______________。

A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com