
 .
. 分析 (1)Ca位于第四周期、最外层电子数为2,最外层电子数为1、内层排满电子的第四周期元素原子是Cu,根据核外电子排布规律书写;
(2)根据等电子体的概念确定与CN22-互为等电子体的分子,根据二氧化碳的空间构型确定CN22-离子的空间构型;
(3)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式和分子空间结构.
解答 解:(1)Ca位于第四周期、最外层电子数为2,最外层电子数为1、内层排满电子的第四周期元素原子是Cu,电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形.
故答案为:CO2;直线形;
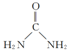
(3)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化,尿素分子的结构简式是 ,
,
故答案为:sp2; .
.
点评 本题考查了物质结构知识,涉及核外电子排布、分子空间构型、杂化原理等,注意杂化理论的熟练应用为高频考点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.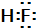 ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
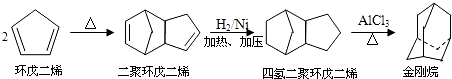
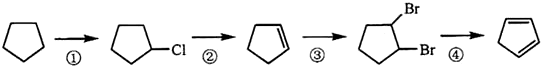
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
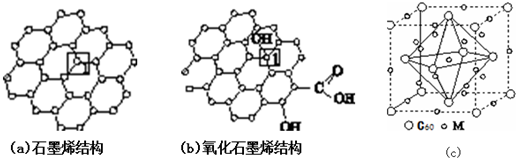
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60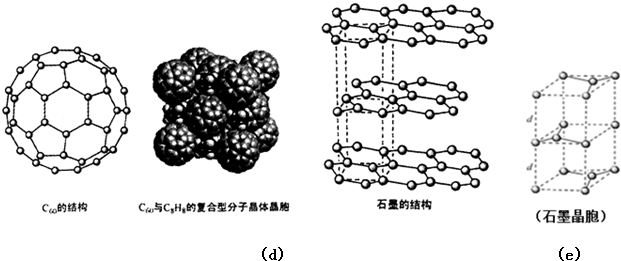
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com