
KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
A.H2C2O4·2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是________________;
②所配制KMnO4标准溶液的物质的量浓度为__________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将________(填“偏高”或“偏低”)。
【答案】(1)将水中还原性物质完全氧化 (2)水浴加热,用温度计控制水温 (3)酸式滴定管 (4)A (5)①滴入最后1滴KMnO4溶液颜色不再褪去 ②W/6.3V (6)偏高
【解析】本题考查了酸性KMnO4溶液的配制。(1)根据题给信息,高锰酸钾溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,所以将溶液加热并保持微沸1h的目的是将水中还原性物质完全氧化。(2)为了保证在700C-800C条件下进行滴定操作,可以水浴加热和用温度计控制水温。(3)高锰酸钾具有氧化性,为了防止氧化橡胶,所以准确量取一定体积的KMnO4溶液用酸式滴定管。(4)选做基准试剂的物质稳定性要好,浓盐酸,FeSO4和Na2SO3易被氧气氧化,所以选A。(5)①滴入最后一滴KMnO4溶液,溶液颜色从无色变成浅红色,且半分钟内不褪色,说明达到滴定终点,根据关系式5H2C2O4-2KMnO4,确定等式为(w/500×25/90):(cV×10-3)=5:2 整理得c=W/6.3V mol·L-1。(6)由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,导致浓度降低,用此溶液做标准溶液导致所测溶液浓度偏高。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有下列三个反应:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br﹣③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O.下列说法正确的是( )
|
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
|
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 |
|
| C. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
|
| D. | 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的用途错误的是( )
|
| A. | 晶体硅是制造太阳能电池的常用材料 |
|
| B. | 二氧化硅是制造光导纤维的材料 |
|
| C. | 氢氟酸可用刻蚀玻璃 |
|
| D. | 硅是制取水泥的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素R、Q、M、T在元素周期表中的相对位置如表,已知R原子最外层电子数与次外层电子数之比为2:1.
| R | Q | ||
| M | T |
(1)人的汗液中含有T的简单离子,其离子结构示意图为 ; 元素M在元素周期表中的位置是 .
(2)R的最高价氧化物所含的化学键类型是 键(选填“离子”或“共价”).
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为 (用具体的化学式表示).
(4)在一定条件下甲、乙、丙有如下转化:甲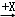 乙
乙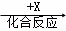 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是 (选填序号).
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是 (选填序号).
①R ②Q2 ③M ④T2
(5)元素T的含氧酸HTO具有漂白性写出HTO的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明碳的非金属性强于硅的是
| A.2C+SiO2 | B.稳定性:CH4>SiH4 |
| C.CaCO3+SiO2 | D.金刚石不导电,晶体硅能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在醋酸溶液中,CH3COOH电离达到平衡的标志是( )
|
| A. | 溶液显电中性 |
|
| B. | 溶液中检测不出CH3COOH分子存在 |
|
| C. | 氢离子浓度恒定不变 |
|
| D. | c(H+)=c(CH3COO﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 0.1 mol•L﹣1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 |
|
| B. | 常温下,在由水电离出的c(OH﹣)=1×10﹣12mol•L﹣1的溶液中,Al3+可能大量存在 |
|
| C. | 常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
|
| D. | 常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 需要加热方能发生的反应一定是吸热反应 |
|
| B. | 放热反应在常温条件下一定很容易发生 |
|
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 |
|
| D. | 灼热的炭与二氧化碳的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
W、M、X、Y、Z表示处于三个短周期的五种主族元素,它们的原子序数依次增大,M与X同周期,W与Y同主族,Y与Z同周期,Z在同周期中原子半径最小,M的气态氢化物甲能使湿润的红色石蕊试纸变蓝色,由Y、W、X三种元素组成的物质乙在水溶液中能电离出两种10电子离子.试回答下列各问:(注意:用相应的元素符号、化学式、离子符号表示.)
(1)元素X在周期表中的位置 .
(2)Z的最高价氧化物对应水化物丙的化学式是 ,写出乙与丙反应的离子方程式 .
(3)元素M的单质分子的电子式为 ,物质甲分子的结构式 .
(4)用电子式表示化合物YZ的形成过程 .
(5)写出X与Y形成原子个数比为1:1的物质丁与水反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com