
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨水呈碱性,与铁离子反应生成氢氧化铁沉淀;
B.酸性条件下,硝酸根离子可氧化亚硫酸根离子;
C.加入氨水,都生成沉淀;
D.用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中,溶液体积不等于100mL.
解答 解:A.氨水呈碱性,与铁离子反应生成氢氧化铁沉淀,且不引入新杂质,可用于除杂,故A正确;
B.酸性条件下,硝酸根离子可氧化亚硫酸根离子,生成硫酸钡沉淀,不能证明含有SO32-,故B错误;
C.加入氨水,都生成沉淀,不能证明Mg的金属性强于Al,故C错误;
D.用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中,溶液体积不等于100mL,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意元素化合物知识与实验的结合.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CO(g)燃烧热△H=-283.0 kJ•mol-1,则反应2CO2(g)=2CO(g)+O2(g)的△H=2×283.0kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,说明金刚石比石墨稳定 | |
| D. | 相同状况下,H2在Cl2中燃烧生成1molHCl和H2与Cl2光照爆炸生成1molHCl的反应热不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 结论 |
| A | 相同条件下,分别测量0.1mol/L和0.01mol/L的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 向Co2O3固体中滴加浓盐酸,有黄绿色气体生成 | 氧化性:Co2O3>Cl2 |
| C | 向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝 | 淀粉未发生水解 |
| D | 常温下,分别测量浓度均为0.1mol/L的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键 | |
| B. | 在水溶液中能导电的化合物一定是离子化合物 | |
| C. | 共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏 | |
| D. | 含有离子键的物质不可能是单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 molHC1和1 molKOH的两种稀溶液混合 | |
| B. | 含1 molHC1和0.5 molKOH 的两种稀溶液混合 | |
| C. | 含0.5mo溶质的浓硫酸和含1mol溶质KOH溶液混合 | |
| D. | 向0.5 mol溶质的浓硫酸和含2mol溶质的KOH溶液混合向1 molNa0H烧碱固体中加入足量1 mol•L-1的硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| D. | 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 大量排放SO2、NO2会导致酸雨的形成 | |
| C. | 废弃的金属、纸制品及玻璃都是可回收再利用的资源 | |
| D. | 纤维素可直接成为人的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
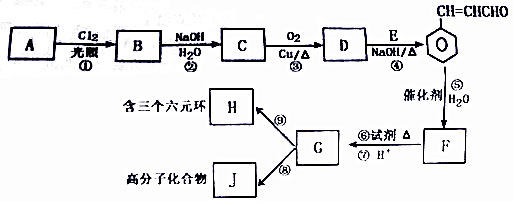
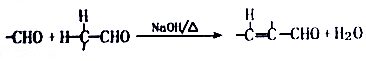
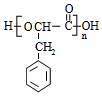 .
.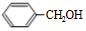 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2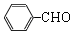 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com