
 .
.分析 (1)“反应后的溶液中滴加KSCN溶液不显红色”说明Fe2(SO4)3不存在,被还原了;进一步推理得知Fe2(SO4)3作反应物且是氧化剂,其还原产物为FeSO4(生成物之一).“有还原必有氧化”,那么只能是SnCl2被氧化成SnCl4.据此可给出反应的总方程式:Fe2(SO4)3+SnCl2+2HCl=2FeSO4+SnCl4+H2SO4;
(2)根据化合价变化分析;
(3)根据化合价的变化判断电子转移的数目,根据电子从还原剂偏移至氧化剂来标出电子转移的方向;
(4)根据氧化还原反应的基本规律,HNO3为反应物,具有强氧化性,则N2O3为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被氧化生成Fe2(SO4)3,该反应为2HNO3+2H2SO4+4FeSO4=2Fe2(SO4)3+N2O3↑+3H2O,以此来解答.
解答 解:(1)“反应后的溶液中滴加KSCN溶液不显红色”说明Fe2(SO4)3不存在,被还原了;可知Fe2(SO4)3作反应物且是氧化剂,其还原产物为FeSO4.“有还原必有氧化”,那么只能是SnCl2被氧化成SnCl4,则n元素被氧化,据此可给出反应的总方程式:Fe2(SO4)3+SnCl2+2HCl=2FeSO4+SnCl4+H2SO4;根据化合价的变化可知,反应中Fe2(SO4)3作氧化剂,
故答案为:Sn;Fe2(SO4)3;
(2)在该反应中,Sn元素的化合价升高被氧化,则发生氧化反应的过程是SnCl2→SnCl4;
故答案为:SnCl2;SnCl4;
(3)反应中SnCl2被氧化成SnCl4,化合价升高2价,故转移的电子数目为2,电子从还原剂移向氧化剂, ;
;
故答案为: ;
;
(4)氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则N2O3为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被氧化生成Fe2(SO4)3,该反应为2HNO3+2H2SO4+4FeSO4=2Fe2(SO4)3+N2O3↑+3H2O,该反应中还原剂与氧化剂的物质的量之比为2:1;
故答案为:2:1.
点评 本题考查氧化还原反应知识,涉及到氧化剂、还原剂的判断,氧化性、还原性的比较以及电子转移的方向和数目,题目比较综合,但难度不大,做题时注意从元素的化合价角度判断反应物和生成物,以此进行分析.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.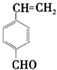 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3和Na2O2 | B. | 铝粉和NaOH | C. | Na2SO3和SO3 | D. | Na2CO3和P2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3水解使溶液呈酸性,并能起净水作用,使水中悬浮的杂质沉降 | |
| B. | 浓度为5mol•L-1和0.5mol•L-1的两种FeCl3溶液,其它条件相同时,Fe3+离子的水解程度前者比后者低 | |
| C. | 加热FeCl3溶液并蒸干,再灼烧,此时得到的固体是无水氯化铁 | |
| D. | 为了抑制Fe3+的水解,更好地保存FeCl3溶液,应向其中加入少量的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com