
常温下,下列有关醋酸溶液的叙述中不正确的是( )
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)减小
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
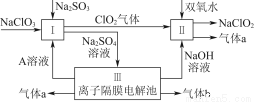
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_____________________________________________________________________________________________________________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2 的原因:________________________________________________________________________
________________________________________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
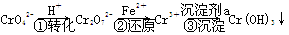
其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:填空题
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
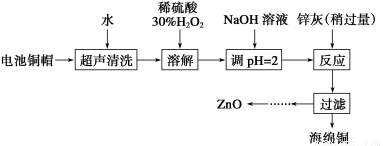
(1)①铜帽溶解时加入H2O2的目的是________________________________________
(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是_______________________________________________________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中发生反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32—+I2=2I-+S4O62—
①滴定选用的指示剂为__________,滴定终点观察到的现象为__________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
、实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为
①______________________________________;
②________________________________________;
③过滤;
④_________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.分离乙醇和乙酸乙酯的混合物,所用玻璃仪器为分液漏斗、烧杯
B.用如图所示装置分离CCl4萃取碘水后已分层的有机层和水层
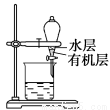
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.用如图所示装置除去乙醇中的苯酚
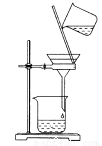
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
甲、乙、丙、丁四支试管,甲、丁中均盛有1 mL的稀酸性KMnO4溶液,乙、丙中分别盛有2 mL溴水+2 g FeBr3、2 mL Br2的CCl4溶液+2 g FeBr3,再向甲、乙中加入适量苯,丙、丁中加入适量的甲苯,充分振荡后静置。下列有关分析中正确的一组是( )
选项甲乙丙丁
A溶液不褪色发生取代反应发生取代反应溶液褪色
B水层不褪色分层,上层呈红棕色溶液褪色甲苯被氧化
C溶液褪色分层,上层呈红棕色无明显变化甲苯被氧化
D分层,下层呈紫红色无明显变化有难溶性油状液体析出无明显变化
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:实验题
3,5?二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5?二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20 ℃) /g·cm-3 | 溶解性 |
甲醇 | 64.7 | — | 0.791 5 | 易溶于水 |
乙醚 | 34.5 | — | 0.713 8 | 微溶于水 |
3,5?二甲氧基苯酚 | — | 33~36 | — | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
实验室中使用铝盐制备氢氧化铝,为了使其中的铝元素完全转化为目标产物,应该选用的试剂是( )
A.碳酸 B.稀硫酸 C.氢氧化钠溶液 D.氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com