
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10ml | 10ml | 40s |
| 40℃ | 20ml | 20ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
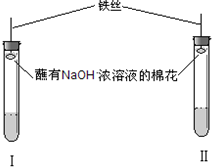
| 实验操作 | 实验现象 | 探究结论 |
| A.取少量品红溶液加入试管Ⅰ中,加入适量碳酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红色 | CO2 |
| B.取少量品红溶液加入试管Ⅱ中,加入适量亚硫酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红,随着反应的进行,颜色又逐渐消失 | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HInH++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
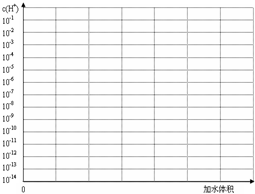
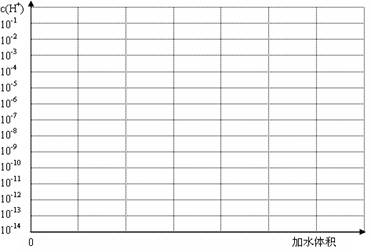
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
查看答案和解析>>
科目:高中化学 来源:2011-2011-2012学年广东省韶关市高三下学期第二次调研考试化学试卷(解析版) 题型:填空题
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
|
温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
|
40 ℃ |
10 ml |
10 ml |
40 s |
|
40 ℃ |
20 ml |
20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中[来源:Z*xx*k.Com]两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com