
(14分)
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
(14分,每空2分)
(1) NH4+ 0.2
(2) AlO2— + CO2(过) + 2H2O = Al(OH)3↓ + HCO3 —
(3) SO42- . 0.5
(4) Fe3+、Mg2+、Ba2+、CO32-
(5) 已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量 ,依据电荷守恒,一定有K+ 存在
【解析】
试题分析:(1)①中与氢氧化钠共热产生气体的溶液中一定含有NH4+,所以100mL的溶液中含有NH4+的物质的量浓度是0.02mol/0.1L=0.2mol/L;该过程无沉淀产生,说明不存在Fe3+、Mg2+;
(2)②向甲溶液中通入过量CO2,因为甲溶液中存在过量的氢氧化钠,所以通入二氧化碳后产生沉淀,则该沉淀一定是氢氧化铝沉淀,加入的氢氧化钠溶液使铝离子转化为偏铝酸根离子,二氧化碳与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸氢根离子,发生的离子方程式为AlO2— + CO2(过) + 2H2O = Al(OH)3↓ + HCO3 —,说明原溶液中存在Al3+,则一定不存在CO32-;1.02g固体为氢氧化铝分解得到的氧化铝的质量,所以铝离子的浓度为1.02g/102g/mol×2/0.1L=0.2mol/L;
(3)第二份加足量BaCl2溶液后,生成白色沉淀,不溶于盐酸,则该沉淀只能是硫酸钡沉淀,说明原溶液中存在SO42-,则与硫酸根离子反应的Ba2+一定不存在;硫酸钡的质量是1.02g,则SO42-的物质的量浓度是11.65g/233g/mol/0.1L=0.5mol/L;
(4)根据以上分析,该溶液中一定不存在的离子是Fe3+、Mg2+、Ba2+、CO32-;
(5)根据电荷守恒,一定存在的离子中,c(NH4+)+3c(Al3+)=0.8mol/L<2n(SO42-)=1.0mol/L,所以溶液中一定还存在阳离子,则K+一定存在。
考点:考查溶液中离子的定性与定量的判断


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
某工厂提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程图如下所示,下列说法错误的是:

A.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器
B.操作①发生的反应为非氧化还原反应
C.操作②是蒸发浓缩结晶
D.在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列操作或记录的数据肯定正确的是
A.用碱式滴定管量取16.00 mL KMnO4溶液
B.用25 mL移液管量取20.00 mL盐酸溶液
C.用托盘天平称取5.6 g食盐
D.用标准盐酸滴定未知浓度的NaOH溶液消耗盐酸的体积为21.5 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
反应2SO2(g)+O2(g)  2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
A.0.1 s B.2.5 s C.5 s D.10 s
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;
A.①②③⑥⑦ B.①③④⑤ C.③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
B.向 NaHSO4溶液中滴加Ba(OH)2溶液至中性: H++SO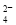 +Ba2++OH-
+Ba2++OH- BaSO4↓+H2O
BaSO4↓+H2O
C.用氯化铁溶液腐蚀铜板:Cu+Fe3+===Cu2++Fe2+
D.用烧碱溶液吸收氯气:Cl2+2OH-==Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:实验题
(本题共12分)
三草酸合铁酸钾(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,110℃时失去全部结晶水。
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4-同时被还原为Mn2+。向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+ 。
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL。
37.配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_____、冷却、转移、洗涤并转移、_____、摇匀。
38.加入锌粉的目的是__________________。
39.写出步骤三中发生反应的离子方程式_______________________。
40.实验测得该晶体中铁的质量分数为______________。在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量_________。(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。
41.请纠正上述实验过程中的两处错误:___________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
下列反应中,反应后体系中的固态物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是

A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸
B.第②步中结晶出的MgCl2·6H2O可在蒸发皿中加热制无水MgCl2
C.在第④步中的反应离子方程式为Br2+SO2+2H2O=2H+ +SO42-+2HBr
D.第⑤步涉及的分离操作有过滤、萃取、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com