
| A. | 放热反应在任何条件都能自发进行 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
分析 A.放热反应△H<0,只有满足△H-T•△S<0才能自发进行;
B.化学反应的热效应数值与参加反应的物质的物质的量成正比;
C.弱酸、弱碱没有完全电离,电离时需吸收能量;
D.焓变是反应物和生成物焓的差值.
解答 解:A.放热反应△H<0,只有满足△H-T•△S<0才能自发进行,故A错误;
B.在一个特定的化学反应中,△H与n成正比,故B正确;
C.只有强酸和强碱的稀溶液中和生成1mol水时,放出的热量才相同,弱酸弱碱没有完全电离,电离时需吸收能量,放出的热量少,故C错误;
D.焓变是反应物和生成物焓的差值,不是1mol物质参加反应时的能量变化,故D错误;
故选B.
点评 本题考查了反应热和反应的自发性判断,难度不大,侧重于基本概念的考查,注意基础知识的积累.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI比HCl稳定 | |
| B. | HI比HCl熔、沸点高 | |
| C. | 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸 | |
| D. | 拆开等物质的量的HI和HCl,HI消耗的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 标准状况下,22.4L己烷中共价键数为19NA | |
| C. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA | |
| D. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入等量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的①NH4Cl溶液 ②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2 CO3 溶液中NH4+浓度的大小关系是②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=244.1 kJ•mol-1 | B. | △H=-488.3 kJ•mol-1 | ||
| C. | △H=-996.6 kJ•mol-1 | D. | △H=996.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
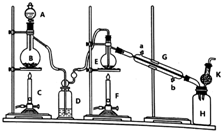 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com