
分析 (1)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,并注意物质的状态来解答;
(2)根据2.0g的物质的量为:$\frac{2}{32}$=0.0625mol,可知1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(g),放出534.4kJ热量,据此书写热化学方程式;
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量,则4Al(s)+3O2(g)═2Al2O3 (s)△H=-1669.8 kJ•mol-1×2=-3339.6kJ•mol-1,由此分析解答;
(4)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水物质的量=$\frac{2.7g}{18g/mol}$=0.15mol,2.24L CO2(标准状况)物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(C)=0.1mol,n(H)=0.3mol,n(O)=$\frac{2.3g-0.1mol×12g/mol-0.3mol×1g/mol}{16g/mol}$=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1,化学式为C2H6O,物质的量为0.05mol,并放出68.35kJ热量,1mol有机物燃烧放热1367KJ,由此书写热化学方程式.
解答 解:(1)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,
则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1;
(2)根据2.0g的物质的量为:$\frac{2}{32}$=0.0625mol,可知1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(g),放出534.4kJ热量,热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O△H=-534.4KJ/mol,故答案为:N2H4(g)+O2(g)=N2(g)+2H2O△H=-534.4KJ/mol;
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量,则4Al(s)+3O2(g)═2Al2O3 (s)△H=-1669.8 kJ•mol-1×2=-3339.6kJ•mol-1,故答案为:4Al(s)+3O2(g)═2Al2O3 (s)△H=-3339.6kJ•mol-1;
(4)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水物质的量=$\frac{2.7g}{18g/mol}$=0.15mol,2.24L CO2(标准状况)物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(C)=0.1mol,n(H)=0.3mol,n(O)=$\frac{2.3g-0.1mol×12g/mol-0.3mol×1g/mol}{16g/mol}$=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1,化学式为C2H6O,物质的量为0.05mol,并放出68.35kJ热量,1mol有机物燃烧放热1367KJ,热化学方程式为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol;故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367 KJ/mol.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| B. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热:检验混合物中是否含有甲醛 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 检验某溴乙烷中的溴元素可向其中加入AgNO3溶液,观察有无浅黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
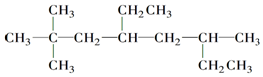 的名称为2,2,6-三甲基-4-乙基辛烷.
的名称为2,2,6-三甲基-4-乙基辛烷.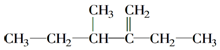 的名称为2-乙基-3-甲基-1-戊稀.
的名称为2-乙基-3-甲基-1-戊稀.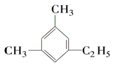 的名称为1,3-二甲基-5-乙基苯.
的名称为1,3-二甲基-5-乙基苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:填空题
下列物质中:①Mg ②液态氯化氢 ③干冰 ④食盐水 ⑤BaSO4 ⑥熔融氢氧化钠⑦稀硫酸 ⑧冰醋酸  ⑨乙醇 ⑩固体氯化钠
⑨乙醇 ⑩固体氯化钠
其中(1)属于电解质的是______ __;
(2)属于非电解质的是_____ ___;
(3)能导电的是____ ____。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com