
(����)���淴Ӧ��C(s)��H2O(g)![]() CO(g)��H2(g)��һ���¶��´ﵽƽ���û�������ƽ����Է�������Ϊa��������ѹǿ���ﵽ�µ�ƽ��״̬���û�������ƽ����Է�������Ϊb��
CO(g)��H2(g)��һ���¶��´ﵽƽ���û�������ƽ����Է�������Ϊa��������ѹǿ���ﵽ�µ�ƽ��״̬���û�������ƽ����Է�������Ϊb��
(1)����ԭƽ������C(s)��H2O(g)Ϊ��ʼ��Ӧ�ィ���ģ���a��b�Ĺ�ϵΪ________��
(2)����ԭƽ������CO(g)��H2(g)Ϊ��ʼ��Ӧ�ィ���ģ���a��b�Ĺ�ϵΪ________��
A��a��b
B��a��b
C��a��b
D������������������
(2)��ԭƽ������CO(g)��H2(g)Ϊ��ʼ��Ӧ�ィ���ģ���a��b������ʼʱCO��H2�������Ϊ________��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��ѧϰ�ܱ�����ѧ���˽̿α�߶���(ѡ��4)��2009��2010ѧ�ꡡ��5�ڡ��ܵ�161�� �˽̿α��(ѡ��4) ���ͣ�022
(����)���ܱ������еĿ��淴Ӧ��CO(g)��NO2(g)![]() CO2(g)��NO(g)(����Ӧ����)����T��ﵽƽ���
CO2(g)��NO(g)(����Ӧ����)����T��ﵽƽ���
(1)�������������ƽ��________��c(NO2)��________����Ӧ��������ɫ________��
(2)Ѹ�������¶���2t�棬�ﵽ�µ�ƽ�����ϵ�¶�t�ķ�Χ��________��
(3)���������NO�����ʵ���________��ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ�ϲ��и������в��Ի�ѧ�Ծ� ���ͣ������
��11�֣��о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⡣
��1��CO�����ںϳɼ״�����ѹǿΪ0.1Mpa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���
CO��g��+2H2��g�� CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��
CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��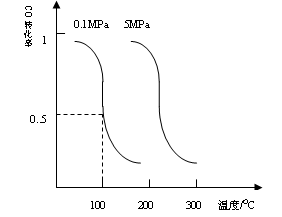
��i���÷�Ӧ����_____________��Ӧ��������ȡ����ȡ�����
��ii��100��ʱ���÷�Ӧ��ƽ�ⳣ����K=_____________������a��b�Ĵ���ʽ��ʾ����
��һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴԴ˷�Ӧ��˵����ȷ���ǣ�_________________����ţ�
| A���÷�Ӧʹ�ô������岻�� |
| B���÷�Ӧ�������ںܶ�ʱ������ɣ� |
| C���÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С�� |
| D���÷�Ӧһ���Ƿ��ȷ�Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��0124 ��ĩ�� ���ͣ������
 CH3OH(g)+H2O(g) ��H��-49.0 kJ/mol�����CO2(g)��CH3OH(g) ��Ũ����ʱ��仯��ͼ��ʾ
CH3OH(g)+H2O(g) ��H��-49.0 kJ/mol�����CO2(g)��CH3OH(g) ��Ũ����ʱ��仯��ͼ��ʾ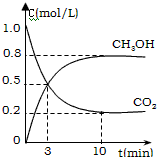
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�о��Ϳ���CO2 ��CO�Ĵ��������ǻ�����������Դ����
��˫Ӯ�Ŀ��⡣
I.CO�����ںϳɼ״�����ѹǿΪ0.1Mpa�����£������ΪbL����
�������г���amolCO��2amolH2���ڴ��������ºϳɼ״�;
![]() ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ:
ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ:
 (1)100��ʱ���÷�Ӧ��ƽ�ⳣ��:
(1)100��ʱ���÷�Ӧ��ƽ�ⳣ��:
K= ��(��a��b�Ĵ���ʽ��
ʾ)����һ�����淴Ӧ��ƽ�ⳣ��Kֵ
�� �Դ˷�Ӧ��˵����ȷ����:
(�����)
A.�÷�Ӧʹ�ô������岻��;
B.�÷�Ӧ�������ںܶ�ʱ�������;
C. �÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��
�ٷֺ�����С��
D.��Ӧ���ת����һ����:
(2)���¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���amolCO��2amolH2���ﵽƽ��ʱ
COת���� (����������䡱��С������ͬ)ƽ�ⳣ���� ��
(3)��ij�¶��£���һ�ݻ�������ܱ������г���2.5molCO��7.5molH2����Ӧ����CH3OH
(g)���ﵽƽ��ʱ��COת����Ϊ90%����ʱ������ѹǿΪ��ʼʱ��ѹǿ ����
11.ij�¶������£�����CO2(g)��H2��g���������1:4��ϣ����ʵ�ѹǿ�ʹ���
�����¿��Ƶü��飬��֪��
![]()
��![]() ��
��![]() ��Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ:
��Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ:
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com