


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
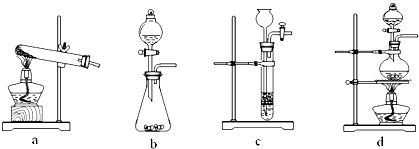
查看答案和解析>>
科目:高中化学 来源: 题型:
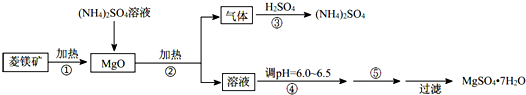
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH3和CH3CH2CH2CH3 |
| B、H2NCH2COOH和CH3CH2NO2 |
| C、CH3CH2COOH和CH3COOCH2CH3 |
| D、CH2=CHCH2CH3和CH2=CHCH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
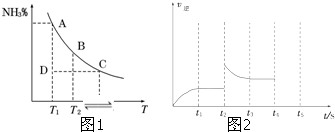
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W1=W2>W4>W3 |
| B、W2>W1>W3>W4 |
| C、W3>W4>W1=W2 |
| D、W2>W1>W4>W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6显弱酸性 |
| B、C(H+)=10-6mol/L,溶液为中性 |
| C、KW是常温时的10-2倍 |
| D、温度不变,加入NaCl固体,pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Pb 为正极被氧化 |
| B、溶液的pH不断减小 |
| C、放电时负极反应式是PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| D、溶液pH不断增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com