
【题目】磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体 PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.0500 mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品 中残留磷化物的质量以判断是否合格。
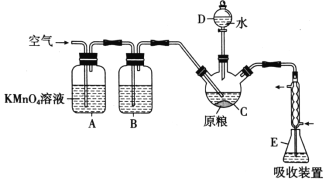
在C中加入100g原粮,E中加入20.00 mL 2.50×10-4 mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器C的名称是___________。
(2)A中酸性高锰酸钾溶液的作用是___________通入空气的作用是______________________。
(3)PH3也可被NaClO氧化可用于制备NaH2PO2,制得的NaH2PO2和NiCl2溶液可用于化学镀镍, 同时生成磷酸和氯化物,请写出化学镀镍的化学方程式为______________________________。
(4)装置E中PH3被氧化成磷酸,充分反应后的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液 20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则滴定终点的现象为______________________________________________。
该原粮样品中磷化物(以PH3计)的残留量为__________________mg/kg。(保留三位有效数字)。
【答案】![]() 三颈烧瓶 吸收空气中的还原性气体,以免使测定结果偏高。 排出装置中空气;保证生成的PH3全部被装置E中的酸性KMnO4溶液吸收 2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl 滴最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色 0.383
三颈烧瓶 吸收空气中的还原性气体,以免使测定结果偏高。 排出装置中空气;保证生成的PH3全部被装置E中的酸性KMnO4溶液吸收 2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl 滴最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色 0.383
【解析】
(1)根据P、H原子结构,分析书写出PH3的电子式;结合示意图辨析仪器;
(2)根据酸性高锰酸钾溶液具有强氧化性分析;根据PH3是气体,滞留在装置中会影响粮食中残留磷化物含量的测定分析;
(3)根据电子得失守恒分析解答;
(4)根据KMnO4溶液的颜色判断,根据氧化还原反应中电子守恒计算。
(1)由于P、H两元素通过共价键结合形成化合物,H原子核外只有一个电子,只能形成一对共用电子对;P原子最外层有5个电子,可结合3个H原子形成三对共用电子对,达到8电子的稳定结构,PH3的电子式是![]() ;由示意图可知仪器C的名称是三颈烧瓶;
;由示意图可知仪器C的名称是三颈烧瓶;
(2)由于空气中也含有还原性气体会干扰后续的实验,因此A中酸性高锰酸钾溶液的作用是吸收空气中的还原性气体,以免使测定结果偏高;AlP与水发生反应产生Al(OH)3和PH3,PH3是气体,会有一部分滞留在三颈烧瓶上部空间内,若通入空气,就可以将三颈烧瓶中空气内的PH3全部赶到E内,被装置E中的酸性KMnO4溶液吸收,以减小实验误差;
(3)NaH2PO2和NiCl2溶液可用于化学镀镍,同时生成磷酸和氯化物,反应中Ni元素化合价从+2价降低到0价,P元素化合价从+1价升高到+5价,所以根据电子得失守恒可知化学镀镍的化学方程式为2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl。
(4)由于酸性高锰酸钾溶液显紫色,则滴定终点的现象为滴入最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色;根据题意可知KMnO4得到电子的物质的量与PH3、Na2SO3失去的电子的物质的量相等,2n(Na2SO3)+8n(PH3)=5n(KMnO4),带入数值:2×10×4.0×10-5mol/L×0.02L+8 n(PH3)=5×2.50×10-4mol/L×0.02L,解得n(PH3)=1.125×10-6mol,m(PH3)=1.125×10-6mol×34g/mol=3.825×10-5g=0.03825mg;则该原粮样品中磷化物(以PH3计)的残留量为0.03825mg÷0.1kg=0.383mg/kg。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活等息息相关,下列说法中正确的是( )
A.“华为P30 Pro”手机中麒麟芯片的主要成分是二氧化硅
B.赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。“灿烂美丽的烟花是某些金属的焰色反应,焰色反应属于物理变化
C.我国自主研发的东方超环(人造太阳)使用的 2H、3H与 1H互为同素异形体
D.熔喷布是医用口罩最核心的材料,熔喷布主要以聚丙烯为主要原料,其结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅥⅠA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)表中能形成两性氢氧化物的元素是______(用元素符号表示),写出该元素与⑨最高价氧化物的水化物反应的化方程式______。
(3)用电子式表示④元素与⑦元素形成化合物的过程______。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是______(填化 学式)。
(5)②的气态氢化物与最高价氧化物对应的水化物反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个容积为V的密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
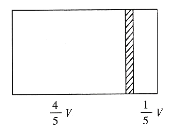
A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是

A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应
B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用
D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com