
 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:分析 (1)已知:①N2(g)+2O2(g)═2NO2(g)△Η1=+67.7kJ/mol、②N2H4(g)+O2(g)═N2(g)+2H2O(g)△Η2=-534kJ/mol,根据盖斯定律②×2-①可得目标反应2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g),△H=△Η2×2-△Η1,带入反应热数据计算即可;
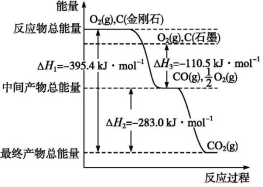
(2)①依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
②依据极图象金刚石不完全燃烧生成CO时放出的热量为395.4kJ-283.0kJ=112.4kJ.
解答 解:(1)已知:①N2(g)+2O2(g)═2NO2(g)△Η1=+67.7kJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△Η2=-534kJ/mol,
根据盖斯定律②×2-①可得:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=△Η2×2-△Η1=-1135.7 kJ/mol,
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7 kJ/mol;
(2)①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJ?mol-1;
故答案为:石墨;393.5kJ?mol-1;
②依据极图象金刚石不完全燃烧生成CO时放出的热量为395.4kJ-283.0kJ=112.4kJ,故答案为:112.4kJ.
点评 本题考查了化学反应与能量、盖斯定律、物质稳定性的判断,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握盖斯定律的含义及其应用方法.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
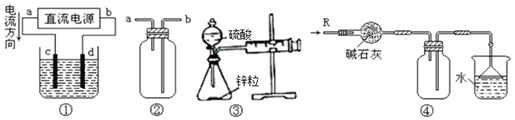
| A. | 装置①中,d为阳极、c为阴极 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 | |
| C. | 装置③结合秒表可测量锌与硫酸的反应速率 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32- 发生水解 | |
| C. | 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理 | |
| D. | 纯碱溶液呈碱性的原因是CO3 2-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定都是酸性氧化物 | |
| B. | 碱性氧化物一定都是金属氧化物 | |
| C. | 既能与酸反应又能与碱反应的物质一定具有两性 | |
| D. | 氧化还原反应一定都是离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时Kw=1.0×10-14,将稀硫酸加热至90℃(忽略溶液体积变化)其pH不变 | |
| B. | pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,所需的氢氧化钠溶液体积前者一定大于后者 | |
| C. | 0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-) | |
| D. | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,即说明Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
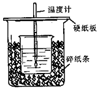 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com