
分析 (一)(1)浓盐酸的物质的量浓度c=$\frac{1000ρω}{M}$;
(2)设所取的浓盐酸的体积为VmL,根据稀释定律c浓•V浓=c稀•V稀来计算;
(二)所取的浓盐酸的质量为10g,故含有的m(HCl)=10g×36.5%=3.65g,则n(HCl)=$\frac{3.65g}{36.5g/mol}$=0.1mol.而1molHCl~1molNaOH,故0.1molHCl所消耗的氢氧化钠的物质的量为0.1mol,质量为m=0.1mol×40g/mol=4g.
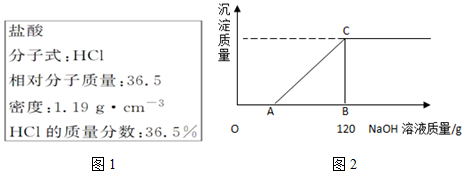
根据题意可知,滴入的氢氧化钠溶液先和HCl反应,后和MgCl2溶液反应.
(1)A点时,是加入的NaOH恰好将HCl完全反应的时刻,据此分析溶液中的溶质;
(2)用消耗氢氧化钠的总量减去盐酸所需的氢氧化钠的量,即为氯化镁所消耗的氢氧化钠的量;
(3)恰好沉淀完全时,C点所得溶液中溶质为NaCl.根据溶液中的钠离子均来自于NaOH并结合钠离子守恒可知溶液中NaCl的物质的量和质量,而溶液的质量=100g+120g-m(Mg(OH)2)据此分析.
解答 解:(一)(1)根据图示可知,浓盐酸的密度为1.19g/mL,质量分数为36.6%,则浓盐酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L.故答案为;11.9;
(2)设所取的浓盐酸的体积为VmL,根据稀释定律c浓•V浓=c稀•V稀可知:11.9mol/L×VmL=500 mL×0.4mol•L-1,解得V=16.8mL.故答案为:16.8;
(二)所取的浓盐酸的质量为10g,故含有的m(HCl)=10g×36.5%=3.65g,则n(HCl)=$\frac{3.65g}{36.5g/mol}$=0.1mol.而1molHCl~1molNaOH,故0.1molHCl所消耗的氢氧化钠的物质的量为0.1mol,质量为m=0.1mol×40g/mol=4g.
根据题意可知,滴入的氢氧化钠溶液先和HCl反应,后和MgCl2溶液反应.
(1)A点时,是加入的NaOH恰好将HCl完全反应的时刻,故A点时溶液中的溶质为NaCl和MgCl2,故答案为:NaCl、MgCl2;
(2)根据题意可知,在C点时,加入的氢氧化钠溶液即将HCl和MgCl2反应完全.此时所需的氢氧化钠溶液的质量为120g,而由于质量分数为10%,故消耗的氢氧化钠溶质的质量为12g.而氯化镁所消耗的氢氧化钠的量=12g-4g=8.0g,故答案为:8.0;
(3)由于沉淀Mg2+所需的NaOH的质量为8.0g,物质的量n=$\frac{8.0g}{40g/mol}$=0.2mol,而根据1molMg2+~2molNaOH可知,MgCl2溶液中n(MgCl2)=0.1mol,则最终生成0.1molMg(OH)2沉淀.
而在C点时,加入的NaOH将溶液中的氢离子和Mg2+恰好反应完全,C点所得溶液中溶质只有NaCl.
根据溶液中的钠离子均来自于NaOH并结合钠离子守恒可知溶液中NaCl的物质的量n(NaCl)=n(NaOH)=$\frac{12g}{40g/mol}$=0.3mol,即溶质的质量m=0.3mol×58.5g/mol=17.55g而溶液的质量=100g+120g-m(Mg(OH)2)=100g+120g-0.1mol×58g/mol=214.2g,
故C点溶质的质量分数=$\frac{17.55g}{214.2g}×100%$=8.2%.
故答案为:8.2%.
点评 根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钙溶液与少量碳酸氢镁溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| C. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe2++H2O2+2H+═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最经固体材料,可用作处理海上原油泄漏的吸油材料 | |
| B. | 过氧化氢酶、酚醛树脂、尼龙、有机玻璃、PVC都是高分子化合物 | |
| C. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| D. | 电解熔融氧化铝、粗硅的制取涉及化学变化,煤焦油中提取苯是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA | |
| B. | 物质的量浓度为0.1mol•L-1的MgCl2溶液中,含有Cl-个数为0.2NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 常温下,22g CO2和N2O混合气体中,含有的原子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:4:3 | C. | 1:4:9 | D. | 1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol•L-1 | B. | 3.25mol•L-1 | C. | 7mol•L-1 | D. | 6.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
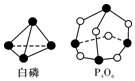 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和(kJ•mol-1)P-P:198 P-O:360 O=O:498;则反应P4(白磷)+3O2═P4O6的能量变化为( )| A. | 释放1638 kJ的能量 | B. | 吸收1638 kJ的能量 | ||
| C. | 释放126 kJ的能量 | D. | 吸收126 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
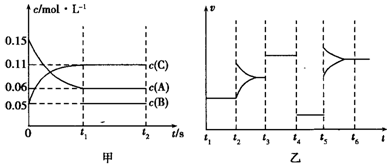
| A. | 若t1=15s,生成物C在t0~t1时间段的化学反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段可能是增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com