

分析 (1)A为非金属单质,D是空气的主要成分之一,则A为C,D为O2,C为CO,由图可知,1molA和D反应生成C放出热量为393.5kJ-282.9kJ=110.6kJ;
(2)A为金属单质,D是某强酸的稀溶液,由图可知,A为Fe,C为硝酸亚铁,B为硝酸铁,D为硝酸;
(3)A、B为盐,D为强碱,A的水溶液显酸性,则A可为AlCl3,D可为NaOH,C为Al(OH)3,B为NaAlO2;
(4)A为强碱,D为气态氧化物,由转化图可知,A可为NaOH,D为CO2或SO2,B为NaHCO3或NaHSO3,常温时将B的水溶液露置于空气中,若为b,则碳酸氢钠符合,若为c则亚硫酸氢钠符合.
解答 解:(1)A为非金属单质,D是空气的主要成分之一,则A为C,D为O2,C为CO,由图可知,1molA和D反应生成C放出热量为393.5kJ-282.9kJ=110.6kJ,则A+D→C的热化学方程式C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6 kJ•mol-1,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6 kJ•mol-1.
(2)A为金属单质,D是某强酸的稀溶液,由图可知,A为Fe,C为硝酸亚铁,B为硝酸铁,D为硝酸,则反应C+D→B的离子方程式为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)A、B为盐,D为强碱,A的水溶液显酸性,则A可为AlCl3,D可为NaOH,C为Al(OH)3,B为NaAlO2,
①由上述分析可知,C为Al(OH)3,
故答案为:Al(OH)3;
②反应B+A→C的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)A为强碱,D为气态氧化物,由转化图可知,A可为NaOH,D为CO2或SO2,B为NaHCO3或NaHSO3,常温时将B的水溶液露置于空气中,若为b,则碳酸氢钠符合,若为c则亚硫酸氢钠符合,
①若图b符合事实,则D为CO2,因碳酸氢钠水解显碱性,则图b中x>7,
故答案为:CO2;>;
②若图c符合事实,亚硫酸氢钠易被氧化生成硫酸氢钠,酸性增强,离子反应为2HSO3-+O2═2H++2SO42-,已知图b中y<7,B的焰色反应为黄色,则B为NaHSO3,溶液呈酸性,HSO3-电离大于水解程度,溶液离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:2HSO3-+O2═2H++2SO42-;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物性质及化学反应原理,侧重分析能力及推断能力的考查,涉及Fe、Al及其化合物转化和非金属及化合物的转化,把握与量有关的反应及氢氧化铝两性等即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
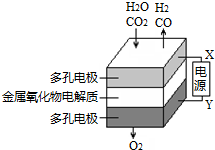 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2e-═H2+O2-,CO2+2e-═CO+O2- | |
| C. | 总反应可表示为:H2O+CO2$\frac{\underline{\;通电\;}}{\;}$H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2s22p3和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p3 | D. | 3s23p1和3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中下图是己经合成的最著名的硫-氮化合物的分子结构.有关该物质说法错误的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中下图是己经合成的最著名的硫-氮化合物的分子结构.有关该物质说法错误的是( )| A. | 分子式为S4N4 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 熔点低于同类晶体S2N2 | D. | 熔沸点低,硬度较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6、CH2═CHCH3 | B. | H2O2、 | C. |  | D. |  1S22S22p63S23p6 1S22S22p63S23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO、MgO、Na2O2均属于碱性氧化物 | B. | 盐酸、醋酸、苯酚均属于强电解质 | ||
| C. | CO2、CCl4、蛋白质均属于有机物 | D. | 液氯、晶体硅、臭氧均属于单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
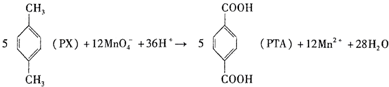
| A. | PX分子中既含σ键又含π键 | |
| B. | PTA是该反应的氧化产物 | |
| C. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| D. | 该反应每消耗1molPX,共转移12NA个电子(NA为阿伏伽德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
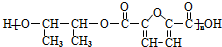 的合成路线如图所示:
的合成路线如图所示: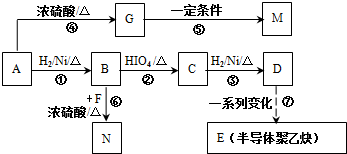
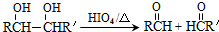
 .
. .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com