

| c(OH)?c(C1O2-) |
| c(HC1O2) |
| c(H+)?c(ClO2-) |
| c(HClO2) |
| c(OH-)?c(ClO2-) |
| c(HClO2) |
| Ka |
| Kw |
| c(H+)?c(ClO2-) |
| c(HClO2) |
| c(OH-)?c(ClO2-) |
| c(HClO2) |
| Ka |
| Kw |
| c(OH-)?c(ClO2-) |
| c(HClO2) |
| Ka |
| Kw |
| ||


科目:高中化学 来源: 题型:
| A、氧化物 | B、难溶于水 |
| C、属于硅酸盐 | D、属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
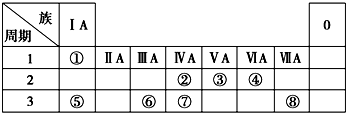
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何物质都含有6.02×1023个原子 |
| B、阿伏加德罗常数就是1mol粒子数的集体,0.012kg12C中含有约6.02×1023个12C |
| C、摩尔是一个基本的物理量 |
| D、1mol水中含有2mol氢和1mol氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 已电离的弱电解质浓度 |
| 弱电解质的初始浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液可由等物质的量浓度、等体积的氨水溶液和盐酸溶液混合而成 |
| B、该溶液可由pH=2的HCl与pH=12的氨水等体积混合而成 |
| C、加入适量的盐酸,溶液中离子浓度为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、加入适量CH3COOH溶液,c(NH4+)一定大于c(Cl-)、c(CH3COO-)之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、②③⑥ |
| C、①②④⑤ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,4υ正(O2)=5υ逆(NO) |
| B、若单位时间内生成x mol NO,同时消耗x mol NH3,则反应达到平衡状态 |
| C、达到平衡时,若增加容器体积,则υ正减少,υ逆增大 |
| D、2min内用NH3表示的反应速率为υ(NH3)=0.75mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com