
【题目】如图所示是某学生设计的实验室制备并干燥Cl2及吸收多余氯气的实验装置图,请回答:
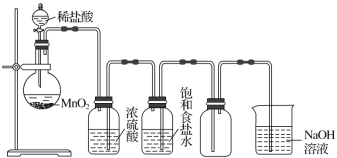
(1)指出上述图中的各处错误:①_______;②_________;③_________;④_________。
(2)在改进后的装置中,下列物质的作用分别是:①饱和食盐水________;②浓硫酸_________;③NaOH溶液_________。
(3)写出下列反应的化学方程式。①圆底烧瓶中进行的离子方程式_____________;
②NaOH溶液中发生的化学反应方程式____________。
【答案】不能用稀盐酸,而应用浓盐酸 应有加热装置,应用酒精灯加热 盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒 两洗气瓶里进气导管和出气导管的长短不对 除去氯气中的氯化氢 除去氯气中的水蒸气 吸收多余的氯气 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O
Mn2++Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
实验室用浓盐酸与二氧化在加热条件下反应制备氯气,浓盐酸易挥发,所以从发生装置中出来的氯气含有氯化氢和水蒸气,先通过饱和食盐水除去氯化氢,然后通过浓硫酸除去水,根据氯气密度大于空气密度,选择向上排气法收集,氯气有毒,应用氢氧化钠溶液吸收,据此解答。
(1)制备氯气应用浓盐酸,条件为加热,洗气时应长进短出,进气管插入液面以下,应该先除去氯气中的氯化氢再除去;
因此该实验装置图中的错误之处:①不能用稀盐酸,而应用浓盐酸;
②应有加热装置,要用酒精灯加热,垫上石棉网,使受热均匀;
③盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒;
④两洗气瓶里进气导管和出气导管的长短不对;
(2)从制取Cl2的装置中出来的Cl2含有HCl和水蒸气,要先通过饱和食盐水除去氯化氢,然后通过浓硫酸除去水蒸气,由于氯气是有毒气体,直接排放会造成大气污染,因此不能直接排放到空气中,需要用氢氧化钠溶液吸收;
(3)①在圆底烧瓶中MnO2与浓盐酸在加热时反应产生MnCl2、Cl2、H2O,反应的离子方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②在NaOH溶液中,Cl2与NaOH发生歧化反应产生NaCl、NaClO、H2O,发生的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图。下列说法错误的是

A. 曲线II表示HA溶液体积
B. x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C. 电离平衡常数K(HA)>K(BOH)
D. 向z点溶液加入NaOH,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:
2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:

A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且甲的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硝酸的说法中正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
D.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
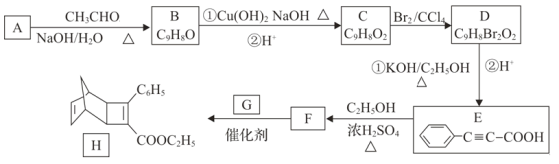
已知:①RCHO+CH3CHO![]()
![]()
![]() RCH=CHCHO
RCH=CHCHO
②![]()
③ +HCHO
+HCHO![]()
 +HCOO-
+HCOO-
回答下列问题:
(1)E中含氧官能团名称为_________非含氧官能团的电子式为_______。E的化学名称为苯丙炔酸,则B的化学名称为__________。
(2)C→D的反应类型为__________。B→C的过程中反应①的化学方程式为 ________。
(3)G的结构简式为_________。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式________。
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有五种不同化学环境的氢且个数比为1:1:2:2:4
(5)写出用甲醛和乙醇为原材料制备化合物C(CH2ONO2)4的合成路线(其他无机试剂任选,合成路线流程图示例见本题题干)。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行反应:mA(气)+nB (气)![]() pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡,
pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡,![]() 随时间化过程均如图所示,则对该反应叙述正确的是
随时间化过程均如图所示,则对该反应叙述正确的是

A. 正反应是放热反应, m+n<p+q
B. 逆反应是放热反应, m+n﹥p+q
C. 正反应是放热反应, m+n﹥p+q
D. 逆反应是放热反应, m+n﹥p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3分两步,将步骤ii补充完整:

ⅰ.NO3+Fe+2H+=NO2+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3)为初始时NO3的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。

(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
(5)利用电解无害化处理水体中的NO3,最终生成N2逸出。其装置及转化图如图所示:

①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是

A. 电子从b流出,经外电路流向a
B. HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-=SO42-+9H+
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com