

 、
、 .
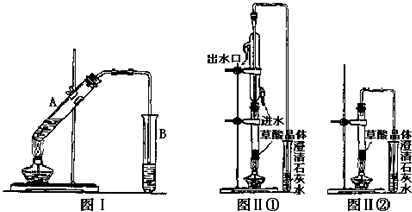
.分析 制备1,2-二溴丙烷,由实验装置可知,分液漏斗和烧瓶a中装有异丙醇和浓硫酸的混合液,加热时发生 ,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生
,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生 ,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,以此来解答;
,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,以此来解答;
解答 解:制备1,2-二溴丙烷,由实验装置可知,分液漏斗和烧瓶a中装有异丙醇和浓硫酸的混合液,加热时发生 ,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生
,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生 ,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,
,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,
(1)根据上面的分析可知,本题中制备1,2-二溴丙烷的两个化学反应方程式为 、
、 ,
,
故答案为: 、
、 ;
;
(2)检验a、b装置的气密性可以在b装置中加水,封住玻璃管下口,关闭分液漏斗旋塞和b、c之间的止水夹,微热圆底烧瓶,若水沿着b中的琉璃管上升,冷却至室温,水又回落至原来位置,则说明a、b装置的气密性良好,
故答案为:在b装置中加水,封住玻璃管下口,关闭分液漏斗旋塞和b、c之间的止水夹,微热圆底烧瓶,若水沿着b中的琉璃管上升,冷却至室温,水又回落至原来位置,则说明a、b装置的气密性良好;
(3)a装置中加入碎瓷片的作用是 防暴沸,根据上面的分析可知,B装置玻璃管的作用 安全装置,防堵塞,
故答案为:防暴沸; 安全装置,防堵塞;
(4)装置e中NaOH溶液的作用是吸收尾气,防止污染空气,
故答案为:吸收尾气,防止污染空气;
(5)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是产生丙烯速度过快,来不及和溴反应就排出了或副反应多,丙烯产量低或异丙醇挥发过多等,
故答案为:产生丙烯速度过快,来不及和溴反应就排出了或副反应多,丙烯产量低或异丙醇挥发过多等.
点评 本题考查制备实验方案的设计,为高频考点,把握有机物的结构与性质、丙烯的制备实验、丙烯的化学性质及实验装置的作用为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com