
选择适宜的材料和试剂设计一个原电池,以便完成下列反应: 2FeCl3+Cu====2FeCl2+CuCl2。画出原电池的示意图并写出电极反应式。
原电池示意图如下: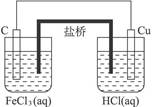
正极:2Fe3++2e- 2Fe2+ 负极:Cu
2Fe2+ 负极:Cu Cu2++2e-
Cu2++2e-
【解析】
试题分析:根据形成原电池的条件,必须选择两个电极和电解质溶液。在反应2FeCl3+Cu====2FeCl2+CuCl2中,Cu是被氧化的,应该是电池的负极上发生的反应,Cu作负极材料最适宜,而正极只能是不如Cu活泼的金属(如Ag、Pt)或碳棒;Fe3+在正极上被还原,所以应选FeCl3的溶液作电解质溶液,最后再选择盐桥。
考点:考查原电池的设计
点评:该题是中等难度的试题,试题注重基础,侧重考查学生综合运用基础知识解决实际问题的能力。该题的关键是根据方程式准确判断出负极材料以及正极放电的离子,然后在具体问题、具体分析即可,有助于培养学生的规范答题能力和严谨的逻辑思维能力。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com