
| A�� | 0.1mol•L-1NH4HS��Һ���У�c��NH4+��=c��HS-��+c��S2-��+c��H2S�� | |
| B�� | 25��ʱ����a mol•L-1�İ�ˮ��0.01mol•L-1������������Ϻ�c��NH4+��=c��Cl-������NH3•H2O�ĵ��볣��Ϊ$\frac{1{0}^{-9}}{a-0.01}$ | |
| C�� | ��Ũ�ȵ�HCN��NaCN�����Һ���У�2c��Na+��=c��CN-��+c��HCN�� | |
| D�� | ��pH�Ģ٣�NH4��2SO4��Һ ��NH4HSO4��Һ ��NH4Cl��Һ�У�c��NH4+���Ĵ�С��ϵ����=�ۣ��� |
���� A���κε������Һ�ж����������غ㣬���������غ��жϣ�
B����25���£�ƽ��ʱ��Һ��c��NH4+��=c��Cl-��=0.005mol/L�����������غ��c��NH3��H2O��=��0.5a-0.005��mol/L�����ݵ���غ��c��H+��=c��OH-��=10-7mol/L����Һ�����ԣ�NH3•H2O�ĵ��볣��Kb=$\frac{c��O{H}^{-}����c��N{{H}_{4}}^{+}��}{c��N{H}_{3}��{H}_{2}O��}$��
C���κε������Һ�ж����������غ㣬���������غ��жϣ�
D������������笠�����ˮ�⣬�Ȼ�狀��������笠�����ˮ��̶���ͬ��
��� �⣺A���κε������Һ�ж����������غ㣬���������غ��c��NH4+��+c��NH3•H2O��=c��HS-��+c��S2-��+c��H2S��������c��NH4+����c��HS-��+c��S2-��+c��H2S������A����
B����25���£�ƽ��ʱ��Һ��c��NH4+��=c��Cl-��=0.005mol/L�����������غ��c��NH3��H2O��=��0.5a-0.005��mol/L�����ݵ���غ��c��H+��=c��OH-��=10-7mol/L����Һ�����ԣ�NH3•H2O�ĵ��볣��Kb=$\frac{c��O{H}^{-}����c��N{{H}_{4}}^{+}��}{c��N{H}_{3}��{H}_{2}O��}$=$\frac{1{0}^{-7}��5��1{0}^{-3}}{0.5a-5��1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$����B��ȷ��
C���κε������Һ�ж����������غ㣬���������غ��2c��Na+��=c��CN-��+c��HCN������C��ȷ��
D��pH�ģ�NH4��2SO4��NH4Cl��Һ�У�����ǿ�������Σ�������Һ�ʵ����Կ��ж϶���NH4+Ũ����ȣ�����NH4HSO4����ʱ����H+ʹ��Һ�����ԣ�NH4+��ˮ�ⱻ���ƣ����NH4HSO4��NH4+��Ũ��С�ڣ�NH4��2SO4���ʴ�ӦΪ����=�ۣ��ڣ���D��ȷ��
��ѡA��
���� ���⿼������Ũ�ȴ�С�Ƚϣ�Ϊ��Ƶ���㣬�漰������ʵĵ��������ˮ�⣬��ȷ��Һ�����ʼ��������ǽⱾ��ؼ���ע�������غ�͵���غ��������ã��ѵ���Bѡ��ļ��㣬��Ŀ�Ѷ��еȣ�


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ش��������⣨��Ϊ25��ʱ�����ݣ�
�������ش��������⣨��Ϊ25��ʱ�����ݣ�| �� | ����ƽ�ⳣ����Ka�� | �� | ����ƽ�ⳣ����Ka�� |
| CH3COOH | 1.7��10-5 | H3BO3 | 5.8��10-10 |
| H2CO3 | Ka1=4.2��10-7 Ka2=5.6��10-11 | HNO2 | 7.1��10-4 |
| HCN | 6.2��10-10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ�Լ��ԣ������ȵĴ�����Һ��ȥ������������� | |
| B�� | ��������ˮ���γ������������壬����������ˮ��ɱ������ | |
| C�� | NH3����ˮ���Լ��ԣ���FeCl3������Һ��ͨ������NH3����ȡFe��OH��3���� | |
| D�� | �����������ܽ�ȱ�������ͭ��С�ö࣬��������ͭ��Һ�м�������������ȥ���е�Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 �������ʽ������ԭ������˫��ˮ������ÿ��Hԭ�Ӻ�Oԭ���γ�һ�Թ��õ��Ӷԣ�Oԭ��֮�乲��һ�Ե��ӣ�����ÿ��ԭ�Ӷ��ﵽ�ȶ��ṹ��
�������ʽ������ԭ������˫��ˮ������ÿ��Hԭ�Ӻ�Oԭ���γ�һ�Թ��õ��Ӷԣ�Oԭ��֮�乲��һ�Ե��ӣ�����ÿ��ԭ�Ӷ��ﵽ�ȶ��ṹ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
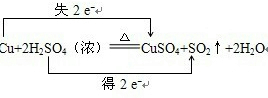 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��ͼ���֪��Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�� | |
| B�� | ���жϷ�Ӧ��������������������������Դ�С | |
| C�� | ��ʾ�˷�Ӧ�����ȷ�Ӧ | |
| D�� | �˷�Ӧ����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol N2 ��������14g | B�� | H2SO4��Ħ��������98 g | ||
| C�� | H2O��Ħ��������18 g/mol | D�� | 1mol HCl��������36.5 g/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������ᷴӦ C032-+2H+�TC02��+H20 | |
| B�� | KI��Һ��ͨ���� 2I��+C12�T2C1?+I2 | |
| C�� | ����ͨ���Ȼ�������Һ�У�Fe2++Cl2�TFe3++2Cl- | |
| D�� | ����������������Һ��Ӧ Hʮ+OH���TH2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com