

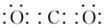 ,若在C池中生成64gCu,则整个装置中共生成H2SO42mol.
,若在C池中生成64gCu,则整个装置中共生成H2SO42mol. 分析 黄铜矿与S在高温下煅烧,使其转变为FeS2、CuS,流程中反应Ⅰ的化学化方程为CuFeS2+S$\frac{\underline{\;高温\;}}{\;}$FeS2+CuS,加入HCl、NaCl、CuCl2混合溶液 发生反应Cu2++CuS+4Cl-=2[CuCl2]-+S↓,过滤得到滤液中通入空气发生反应4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,结晶分离得到硫酸铜晶体,加入铁还原溶液得到铜;滤渣分离得到FeS和S,FeS2通入空气灼烧得到氧化铁和二氧化硫,氧化铁炼钢,二氧化硫制备硫酸.
(1)铁红是氧化铁的俗称;
(2)在氧化还原反应中失去电子,化合价升高的反应物为还原剂;
(3)黄铜矿分解生成的Fe、Cu均为+2价,据此可判断反应Ⅰ的产物;
(4)反应Ⅲ中生成铜离子,据此书写离子反应方程式;
(5)A池中二氧化硫失去电子生成硫酸根离子,B池中一氧化碳和氧气反应生成二氧化碳,若在C池中生成64gCu,根据得失电子守恒计算.
解答 解:(1)铁红的成分是氧化铁,常用作红色油漆和涂料,其化学式为:Fe2O3,
故答案为:Fe2O3;
(2)黄铜矿与S在高温下煅烧,使其转变为FeS2、CuS,流程中反应Ⅰ的化学化方程为CuFeS2+S$\frac{\underline{\;高温\;}}{\;}$FeS2+CuS,加入HCl、NaCl、CuCl2混合溶液,反应Ⅱ的离子方程式为Cu2++CuS+4Cl-═2CuCl2-+S,CuCl2-中氯离子的化合价为-1价,2个氯离子为-2价,则铜元素的化合价为+1价;反应中化合价变化为:CuS中的硫升高(-2→0),铜降低(+2→+1),CuS中的硫失去电子被氧化,则CuS为还原剂,
故答案为:CuS;
(3)反应Ⅱ的离子方程式为Cu2++CuS+4Cl-═2CuCl2-+S,结合流程可知,黄铜矿分解生成的Fe、Cu均为+2价,反应Ⅰ的化学化方程为CuFeS2+S$\frac{\underline{\;高温\;}}{\;}$FeS2+CuS,则反应I的产物为:FeS2、CuS,
故答案为:FeS2;
(4)反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,
故答案为:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(5)A池中二氧化硫在阳极放电,失去电子生成硫酸根离子,电极反应式:SO2+2H2O-2e-=SO42-+4H+,B池中一氧化碳和氧气反应生成二氧化碳,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: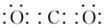 ,若在C池中生成64gCu,为1mol铜,铜离子得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu,将上述两电极的电极反应式得:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu,生成2molH2SO4,
,若在C池中生成64gCu,为1mol铜,铜离子得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu,将上述两电极的电极反应式得:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu,生成2molH2SO4,
故答案为:SO2+2H2O-2e-=SO42-+4H+;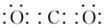 ;2.
;2.
点评 本题以实际化工生产“黄铜矿的综合利用”为背景,考查了元素化合物知识,离子方程式和化学方程式的书写及有关计算,题目更注重考查学生利用化学原理来解决实际问题的能力,注意电解反应原理以及离子方程式的书写,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
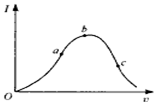 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由上述反应可知,ClO-的氧化性强于FeO42- | |
| B. | 高铁酸钾中铁显+6价 | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为2:3 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
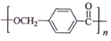 的路线:
的路线: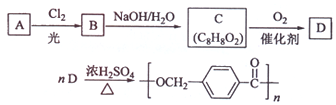
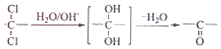
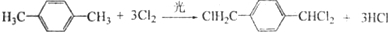 ;
;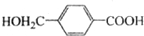 ,由D合成聚酯类高分子材料
,由D合成聚酯类高分子材料 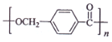 的化学方程式是n
的化学方程式是n $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +(n-1)H2O
+(n-1)H2O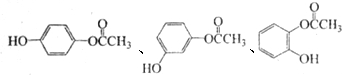 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 | |
| C. | “84”消毒液主要成分为次氯酸钠,与适量白醋混合使用消毒效果会更好 | |
| D. | 夏季马路喷洒氯化钙溶液,氯化钙跟水分子结合形成结晶水合物起到保湿作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
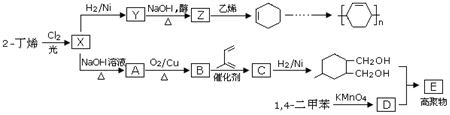
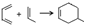 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 | |
| B. | 将纳米材料(微粒直径是1nm-100nm)分散到分散剂中得到的分散系有丁达尔效应 | |
| C. | 氢氧化铁胶体的制备方法是:将氢氧化铁固体溶于沸水中继续煮沸 | |
| D. | 胶体与其它分散系的本质区别是胶体的分散质粒子的微粒直径在1nm-100nm之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com