
| A. | ①⑤⑦ | B. | ②⑤ | C. | ⑤⑦ | D. | 除③④外 |
分析 ①离子键与共价键均为化学键;
②稀气体分子中不存在任何化学键;
③铵盐由非金属元素形成的离子化合物;
④阴、阳离子之间存在静电吸引力和静电斥力;
⑤活泼金属与活泼非金属化合时存在电子转移能形成离子键;
⑥BF3中B原子周围只有6个电子;
⑦离子化合物在熔融时能电离,共价化合物在熔融时不电离;
⑧熔融NaCl能电离出自由移动的Na+和Cl-;
⑨化学变化中存在新键的断裂和旧键的形成.
解答 解:①离子键与共价键均为化学键,本质都是静电作用,故正确;
②单原子分子中没有化学键,如稀有气体中没有化学键,故错误;
③铵盐是由非金属元素形成的离子化合物,所以由非金属元素形成的化合物可能是离子化合物,故错误;
④阴、阳离子之间存在静电吸引力和静电斥力,故错误;
⑤活泼金属与活泼非金属化合时存在电子转移、形成阴离子和阳离子,阴离子与阳离子之间能形成离子键,故正确;
⑥BF3中B原子周围只有6个电子,不满足稳定结构,故错误;
⑦离子化合物在熔融时能电离,所以能导电,共价化合物在熔融时不电离,不能导电,所以判断化合物是否为离子化合物的实验方法是看其熔化下能否导电,故正确;
⑧熔融NaCl能电离出自由移动的Na+和Cl-,电离与电流无关,故错误;
⑨化学变化中存在新键的断裂和旧键的形成,只存在化学键的断裂不一定发生化学变化,如HCl溶于水,共价键被破坏,但是属于物理变化,故错误.
故选A.
点评 本题考查了化学键、电解质的电离、溶液的导电性、化学变化等,题目难度不大,侧重于基础知识的考查,注意铵盐是由非金属元素形成的离子化合物.


科目:高中化学 来源: 题型:实验题
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | i.向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子是Zn2+ | |
| C. | 当有第三种单质生成时,消耗的锌粉质量至少大于13 g | |
| D. | 反应结束时,可得到0.25 mol ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有铵盐受热均可分解,产物均有NH3 | |
| B. | 所有铵盐都易溶于水,不是所有铵盐中的氮都呈-3价 | |
| C. | NH4Cl溶液中加入NaOH浓溶液供热,反应的离子方程式为NH4+OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| D. | NH4Cl和NaCl的固体混合物可用加热法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
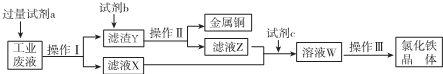
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c可以是H2O2溶液或氯气 | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol、2 mol | B. | 1 mol、4 mol | C. | 3 mol、2 mol | D. | 3 mol、4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{125a}{72V}$ mol•L-1 | B. | $\frac{125a}{36V}$ mol•L-1 | C. | $\frac{250a}{36V}$ mol•L-1 | D. | $\frac{250a}{48V}$ mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com