
分析 先根据反应方程式计算出平衡时消耗二氧化硫的物质的量,然后根据v=$\frac{\frac{△n}{V}}{△t}$计算出0~2min内用SO2(g)表示的该反应的速率.
解答 解:2min时达平衡,此时CaSO4(s)为1.8mol,根据反应2CaO(s)+2SO2(g)+O2(g)?2CaO4(s)可知平衡时消耗二氧化硫的物质的量为:1.8mol×$\frac{2}{2}$=1.8mol,
则0~2min内,用SO2(g)表示的该反应的速率为:v(SO2)=$\frac{\frac{1.8mol}{10L}}{2min}$=0.09mol/(L•min),
故答案为:
点评 本题考查了化学反应速率的计算,题目难度不大,明确化学反应速率的概念及表达式为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:多选题
| A. | 甲酸溶液中水的离子积Kw比乙酸强 | |
| B. | c(酸)相同时,甲酸的导电性比乙酸强 | |
| C. | c(H+)相同时,乙酸的物质的量浓度比甲酸大 | |
| D. | c(酸)相同时,甲酸溶液的pH比乙酸大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
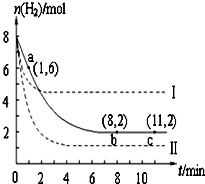 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | T℃时,该反应的化学平衡常数为0.125 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应?△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含有离子键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 含有离子键的化合物一定属于离子化合物 | |
| D. | 含共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| B. | 根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3 | |
| C. | 常温下,将醋酸稀溶液加水稀释,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 已知反应:3H2(g)+WO3(s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com