
| A. | 氧化剂是甲醇 | |
| B. | 氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 氧化产物是二氧化氯 | |
| D. | 还原产物与氧化产物的物质的量之比为6:1 |
分析 该反应中,碳元素化合价由-2价变为+4价,氯元素化合价由+5价变为+4价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物.
解答 解:A.该反应中,碳元素化合价由-2价变为+4价,所以甲醇是还原剂,故A错误;
B.该反应中,碳元素化合价由-2价变为+4价,氯元素化合价由+5价变为+4价,所以氧化剂是NaClO3,还原剂是甲醇,则氧化剂和还原剂的物质的量之比是6:1,故B错误;
C.该反应中,碳元素化合价由-2价变为+4价,氯元素化合价由+5价变为+4价,所以氧化剂是NaClO3,则二氧化氯是还原产物,故C错误;
D.该反应中氧化产物是CO2,还原产物是ClO2,所以还原产物和氧化产物的物质的量之比是6:1,故D正确;
故选D.
点评 本题考查了氧化还原反应中有关概念及物质的量的判断,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
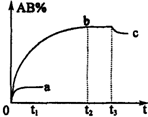 反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中至少有一种为非气体,Q<0 | |
| C. | AB为气体,A2、B2中有一种为气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀 | |
| B. | 溶液和胶体都是纯净物,浊液是混合物 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(g)与HCl(g)反应生成NH4Cl(s) | B. | 氯化钠溶于水中 | ||
| C. | CaCO3(S)分解为CaO(S)和CO2(g) | D. | 干冰(CO2)的升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ②③⑤ | C. | ①②④⑥⑦ | D. | ①②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质不是电解质就是非电解质 | |
| B. | 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物 | |
| C. | 能导电的物质不一定是电解质,电解质不一定能导电 | |
| D. | 液氨溶于水能导电,所以是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精受热变为气体 | B. | 氯化铵受热变为气体 | ||
| C. | 二氧化硅受热熔化 | D. | 食盐溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com