
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题:
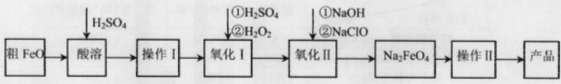
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律________________________________________________________。
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
(1)升高温度加快反应速率 或 增大接触面积加快反应速率 或 提高酸溶效率(2分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O(3分) (3)①Cl2+2OH-=Cl-+ClO-+H2O(2分)
②温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,NaClO浓度随温度升高而降低。(2分)温度小于30℃时,升高温度,反应速率增大;温度高于30℃时,NaClO不稳定而分解。(2分)
(4)如右图 :(阴极材料可为Cu或Fe)(3分)
:(阴极材料可为Cu或Fe)(3分)
Fe - 6e-+ 8OH- =FeO42-+ 4H2O(2分)
【解析】
试题分析:(1)高温水蒸气可以作答固体与酸反应的接触面积,同时升高温度反应速率也加快,因此粗FeO酸溶过程中通入水蒸气(高温),其目的是升高温度加快反应速率或增大接触面积加快反应速率或提高酸溶效率。
(2)操作I目的是得到高纯度FeSO4溶液,由于双氧水具有氧化性,能把亚铁离子氧化生成铁离子,则氧化I中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)①Cl2与NaOH溶液反应制备次氯酸钠的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
②根据表中数据可知温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,NaClO浓度随温度升高而降低。这是由于温度小于30℃时,升高温度,反应速率增大;而温度高于30℃时,NaClO不稳定而分解导致浓度降低。
(4)根据Fe+2OH-+2H2O电解FeO42-+3H2↑可知,铁失去电子被氧化,因此铁是阳极与电源的正极相连,而电解质溶液是碱性溶液,所以装置图可以是 ,其中阳极反应式为Fe - 6e-+ 8OH- =FeO42-+ 4H2O。
,其中阳极反应式为Fe - 6e-+ 8OH- =FeO42-+ 4H2O。
考点:考查外界条件对反应速率的影响、离子方程式书写以及电化学原理的应用


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
某元素最高价含氧酸的化学式是H2RO4,该元素的气态氢化物化学式可表示为
A.HR B.H2R C.RH3 D.不能确定
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市毕业班综合测试三 理综化学试卷(解析版) 题型:选择题
HF为一元弱酸,在0.1mol·L-1 NaF溶液中,离子浓度关系正确的是
A.c(Na+)>c(F-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(F-)>c(H+)
C.c(Na+) + c(OH-)=c(F-) + c(H+) D.c(Na+) + c(H+)=c(F-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月综合测试理综化学试卷(解析版) 题型:填空题
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下:
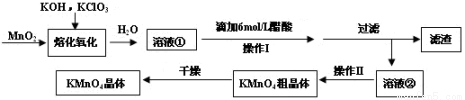
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月综合测试理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞试液显红色的溶液中:K+、Na+、Cu2+、SO42—
B.在c(H+)/c(OH—)=10—12的溶液中:K+、Ba2+、Cl—、ClO—
C.水电离产生的c(H+)=10—13mol?L—1 的溶液中:Na+、Cl—、NO3—、CH3COO—
D.pH=0的溶液中:Na+、NO3—、S2—、Cl—
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省佛山市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
下列有关说法错误的是
A.为保护海轮的船壳,常在船壳上镶入锌块
B.纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应
C.已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.NH3(g) + HCl(g)== NH4Cl(s) 较低温度下能自发进行,说明该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:推断题
(16分)下图中A、B、C、D、E、F、G均有机化合物。据图回答问题:
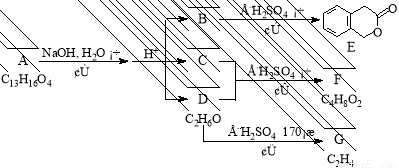
(1)D的化学名称是 。
(2)反应③的化学方程式是 。(有机物须用结构简式表示,下同)
(3)B的分子式是 ,A的结构简式是 。反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体的数目有多个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、
iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(5)反应④的化学方程式是 。
G是重要的工业原料,用化学方程式表示G形成高聚物的反应
。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能发生加成反应,乙烷不能发生加成反应
C.甲苯能使酸性高锰酸钾溶液褪色,乙烷、苯不能使酸性高锰酸钾溶液褪色
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高一下学期期末考试化学试卷(解析版) 题型:选择题
海水资源的利用包括海水的淡化,以下方法中,不能淡化海水的是
A.蒸馏法B.过滤法C.电渗析法D.离子交换法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com