
【题目】某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:
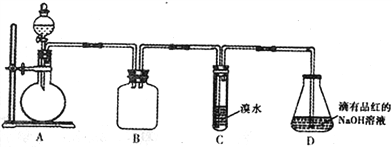
(1)装置B的作用是_______________________。
(2)装置C的目的是检验SO2的_____性。装置D中NaOH全部转化为NaHSO3的标志是_______________。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | __________ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | ______ |
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________(填“偏高”、偏低”或“不变”)。
【答案】 防倒吸(或安全瓶) 还原 溶液红色褪色 常温下,用PH试纸(或PH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb 溶液变为蓝色 溴水褪色 Ⅰ或Ⅲ 0.16 偏低
【解析】由图可知,A中发生铜与浓硫酸的反应生成二氧化硫,B为安全瓶,可防止倒吸,C中发生反应SO2+Br2 +2H2O==H2SO4+2HBr,D中氢氧化钠溶液吸收尾气。(1)装置B的作用是防倒吸(或安全瓶);(2)装置C中发生反应中S元素的化合价升高,则设计装置C的目的是检验SO2的还原性;装置D中NaOH全部转化为NaHSO3的标志是溶液红色褪色;(3)电离呈酸性,水解显碱性,则测定pH即可,设计实验为:室温下,用pH试纸(或pH计)测定NaHSO3溶液pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb;(4)②NaClO可氧化,则观察到溶液变为蓝色;③溴水可氧化HSO3-,则观察到溴水褪色;④HSO3-与高锰酸钾可发生氧化还原反应,由溶液为紫色可知,不存在HSO3-,则Ⅰ或Ⅲ成立。故答案为:
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | Ⅰ或Ⅲ |
(5)①令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+I2 +2H2O==H2SO4+2HI
64g 1mol
mg 0.025L![]() 0.01mol/L,所以64g:mg=1mol: 0.025L
0.01mol/L,所以64g:mg=1mol: 0.025L![]() 0.01mol/L,解得m=0.016g/L;②若有部分HI 被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低。
0.01mol/L,解得m=0.016g/L;②若有部分HI 被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ.R1COOR2+ R318OH![]() R1CO18OR3+R2OH(R1、R2、R3代表烃基)
R1CO18OR3+R2OH(R1、R2、R3代表烃基)
![]() Ⅱ.
Ⅱ. (R4、R5代表烃基)
(R4、R5代表烃基)
(1)①的反应类型是 。
(2)②的化学方程式为 。
(3)PMMA单体的官能团名称是 、 。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为 。
(5)G的结构简式为 。
(6)下列说法正确的是 (填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.1 mol  与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是 。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷和苯的性质叙述错误的是( )
A.甲烷和苯均属于烃,均难溶于水
B.苯的分子结构中存在单双键交替的现象,所以能使酸性高锰酸钾溶液褪色
C.甲烷和苯在一定条件下均能发生取代反应
D.苯在空气中燃烧比甲烷在空气中燃烧时火焰亮,烟浓厚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅣA、ⅤA、ⅥA、ⅦA 四个主族元素的氢化物的沸点变化趋势如下图所示,分析图中的递变规律,下列结论中正确的是( )

A. CH4 分子间的氢键较弱,故其沸点较低
B. 图中的横坐标的数值表示的是中心原子的主族序数
C. ⅣA 族元素氢化物的稳定性随相对分子质量的递增逐渐增强
D. H2O、HF、NH3 三种物质的沸点比同主族的其他氢化物都高,是因 为组成这三种物质的分子间均可形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点 A2D<A2X
B. CA3 分子是非极性分子
C. B、C、D 形成的气态氢化物互为等电子体
D. C 形成的常见单质中 σ 键与 π 键个数之比为 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于第三周期第ⅥA族。下列叙述不正确的是
A. 该元素是非金属元素 B. 该元素原子的核电荷数为16
C. 该元素原子核外有3个电子层 D. 该元素原子容易失去最外层电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模拟足贝类足丝蛋白的功能,合成了一种对云母、玻璃、二氧化硅等材料具有良好粘附性的物质一化合物I,其合成路线如下:
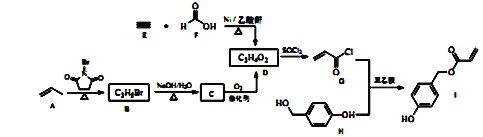
回答下列问题:
(1)A的化学名称为_____________________。
(2)由B生成C的化学方程式为_____________________________。
(3)由E和F反应生成D的反应类型为__________,由G和H反应生成I的反应类型为___________。
(4)D的结构筒式为____________,仅以D为单体合成高分子化合物的化学方程式为___________________。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com