
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,通入N2,压强增大,反应速率加快
C. 升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
D. 该反应化学方程式为CO+H2O![]() CO2+H2
CO2+H2
【答案】A
【解析】
平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数k=![]() ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2![]() CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应。
CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应。
A、恒容时,温度升高,H2浓度减小,平衡正向移动,则该反应为吸热反应,所以△H>0,故A正确;
B、反应前后气体体积不变,恒温恒容下,通入N2,压强增大,平衡不移动,故B错误;
C、升高温度,正、逆反应速率都增大,正反应速率增大更多,平衡正向移动,故C错误;
D、,平衡常数k=![]() ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2![]() CO+H2O,故D错误;
CO+H2O,故D错误;
故选A。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是__(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是___、_____和______。

(2)在容量瓶的使用方法中,下列操作不正确的是____
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称量NaOH固体___g。称量NaOH固体需注意选择用___盛装NaOH固体。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1mol/L(填“大于”、“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为____mL,如果实验室有15mL、20mL、50mL量筒,应选用___mL量筒最好。
(5)若实验过程中加蒸馏水时不慎超过了刻度应____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)= CO2(g)+CaO(s) △H=+178.2kJ/mol
SO2(g)+CaO(s)= CaSO3(s) △H=-402kJ/mol
2CaSO3(s)+O2(g )= 2CaSO4(s) △H=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol
N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H=-64.2kJ/mol
N2(g)+2CO2(g) △H=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:

①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。

(5)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:

(1)“制酸”过程中生成磷酸的化学方程式为___________________________________________________。
该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是___________________________________。
(2)“反应”中加入有机碱——三辛胺(TOA)的目的是____________________________________________。
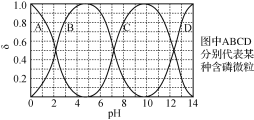
(3)“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。
①“反应”中,当pH=____时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是_____________________________________________。
(4)查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,________________,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间发生的化学反应属于吸热反应的是( )
A. 木炭和氧气B. 生石灰和水C. 盐酸和氢氧化钠溶液D. NH4Cl晶体和Ba(OH)28H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
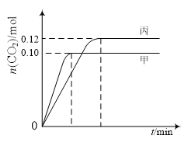
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
Ⅱ.配制1 mol/L的稀硫酸溶液500 mL。回答下列问题。
(5)需要质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_________mL(计算结果保留一位小数)。如果实验室有25 mL、50 mL、10 0mL量筒,应选用________mL规格的量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00mL水溶液。
②量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L1的KMnO4溶液滴定到滴入最后一滴KMnO4半分钟后不再褪色为止。
所发生反应:KMnO4+H2C2O4+H2SO4——K2SO4+CO2↑+MnSO4+H2O(未配平)。
试回答:
(1)实验中不需要的仪器有_____(填序号),还缺少的仪器有_____。
a.托盘天平(带砝码,镊子);b.滴定管;c.100 mL量筒;d.滴定管夹;e.烧杯;f.漏斗;g.锥形瓶;h.玻璃棒;i.药匙;f铁架台。
(2)实验中,标准液KMnO4溶液应装在_________式滴定管中。
(3)误差讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会_____(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会_____。
(4)在滴定过程中若用a mol·L1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为_________mol·L1,由此可计算x值是_________。(用代数式表达)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com