
分析 (1)反应后的溶液中存在碳酸根离子,则碳酸钠与盐酸反应没有生成二氧化碳气体,CO32-和HCO3-的物质的量之和等于原溶液中碳酸钠的物质的量;设出原溶液中碳酸钠、碳酸氢钠的物质的量分别为x、y,根据反应后的溶液中CO32-和HCO3-的物质的量之比为2:1可知反应生成碳酸氢钠的物质的量为$\frac{1}{3}$y,然后分别根据钠离子守恒、消耗氯化氢的总物质的量列式计算,最后根据c=$\frac{n}{V}$计算出原溶液中氢氧化钠、碳酸钠的浓度;
(2)当完全反应得到NaCl溶液时甲基橙变色,根据钠离子和氯离子物质的量相等列式计算;
(3)根据碳原子守恒,若反应完全时n(CO2)=n(Na2CO3)-n(H2CO3),带入V=n•Vm计算体积.
解答 解:(1)设原混合液中NaOH和Na2CO3的物质的量分别为x和y则:
NaOH+HCl═NaCl+H2O
x x
Na2CO3+HCl═NaHCO3+NaCl
$\frac{y}{3}$ $\frac{y}{3}$
$\left\{\begin{array}{l}{x+2y=4.4mol•{L}^{-1}×0.1L}\\{x+\frac{y}{3}=2.0mol•{L}^{-1}×0.12L}\end{array}\right.$
解得x=0.2mol,y=0.12mol,
c(NaOH)=$\frac{0.2mol}{0.1L}$=2mol/L,
c(Na2CO3)=$\frac{0.12mol}{0.1L}$=1.2mol/L,
答:原混合液中NaOH和Na2CO3的物质的量浓度分别为2mol/L、1.2mol/L;
(2)4.4 mol•L-1×0.1L=2 mol•L-1V(盐酸)+0.120L×2 mol•L-1,
解得V(盐酸)=100mL,
答:若用甲基橙作指示剂,在滴定时尚需再加100ml升盐酸,才能使甲基橙变色;
(3)根据碳原子守恒,若反应完全时n(CO2)=n(Na2CO3)-n(H2CO3)=0.12mol-0.04 mol•L-1×0.32L=0.107mol,
V(CO2)=0.107mol×22.4L/mol=2.4L,
答:若反应完全时,溶液中H2CO3的浓度为0.04mol•L-1且溶液体积假定不变,可得CO2气体2.4升.
点评 本题考查了混合物反应的有关计算,题目难度中等,明确反应的先后顺序及反应产物为解答关键,注意质量守恒在化学计算中的应用方法,试题有利于培养学生的分析、理解能力及化学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 组成和结构信息 |
| a | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| b | 化学组成为BDF2 |
 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
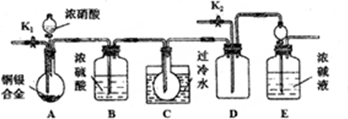
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
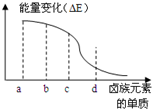 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
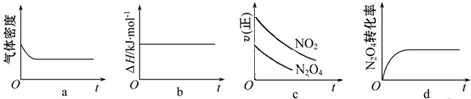
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A<B<C | |
| B. | A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体 | |
| C. | A单质的熔点高于C单质 | |
| D. | A与B或C均可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| B. | 硅单质可用作光导纤维的原料 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液pH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为乙醇是有机物,所以乙醇不溶于水 | |
| B. | 乙醇能燃烧 | |
| C. | 乙醇在一定条件下能够被氧化成乙醛 | |
| D. | 乙醇能与水以任意比例混溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com