
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
分析 (1)醇能和水形成氢键的物质而易溶于水;1-溴丁烷的密度大于水,且和水不互溶;
(2)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解溶液温度升高易使溴化氢挥发;
(3)1-溴丁烷和正丁醇的沸点相差较小,不能采用蒸馏的方法分离;
(4)溴代烷在碱溶液中水解,碘化钠和溴单质反应生成碘单质,氯化钠不能除去溴单质;
(5)根据平衡移动原理分析采用边反应边蒸出产物的原因;根据1-溴丁烷和正丁醇的沸点的沸点大小判断.
解答 解:(1)醇能和水形成氢键的物质而易溶于水,溴代烃和水不反应也不能和水形成氢键,所以溴代烃的水溶性小于相应的醇;
故答案为:小于;醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键;
(2)1-溴丁烷和水不能形成氢键所以不易溶于水,且密度大于水,所以将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层,
故答案为:下层;
(3)A.浓硫酸和1-丁醇反应发生副反应消去反应生成烯烃、分子间脱水反应生成醚,稀释后不能发生类似反应减少副产物烯和醚的生成,故a正确;
B.浓硫酸具有强氧化性能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成,故b正确;
C.反应需要溴化氢和1-丁醇反应,浓硫酸溶解溶液温度升高,使溴化氢挥发,稀释后减少HBr的挥发,故c正确;
D.水是产物不是反应的催化剂,故d错误;
故答案为:ABC;
(4)欲除去溴代烷中的少量杂质Br2,
A.NaI和溴单质反应,但生成的碘单质会混入,故a错误;
B.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液发生水解反应,故b错误;
C.溴单质和NaHSO3 溶液发生氧化还原反应,可以除去溴单质,故c正确;
D.KCl不能除去溴单质,故d错误;
故答案为:C;
(5)根据题给信息知,乙醇和溴乙烷的沸点相差较大,采用边反应边蒸出产物的方法,可以使平衡向生成溴乙烷的方向移动,而1-溴丁烷和正丁醇的沸点相差较小,所以不能边反应边蒸出产物,
故答案为:平衡向生成溴乙烷的方向移动(或反应②向右移动);1-溴丁烷和正丁醇的沸点相差不大.
点评 本题考查了制备实验方案的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,明确物质的性质及实验原理是设计实验的前提,同时考查了学生分析问题、解决问题的能力,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
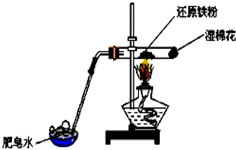
| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
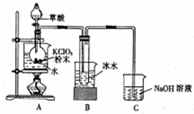 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
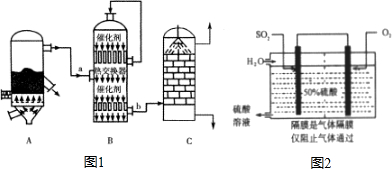 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
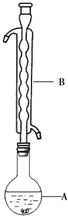
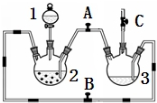 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次来 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com