
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1 L 1mol/L的硫酸钠溶液中,所含Na+数为NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe含有原子数NA |
分析 A、二氧化碳为三原子分子;
B、求出硫酸钠的物质的量,然后根据硫酸钠中含2个钠离子来分析;
C、标况下水为液态;
D、铁由铁原子构成.
解答 解:A、二氧化碳为三原子分子,故1mol二氧化碳中含3NA个原子,故A错误;
B、溶液中的硫酸钠的物质的量n=CV=1mol/L×1L=1mol,而硫酸钠中含2个钠离子,故1mol硫酸钠中含2NA个钠离子,故B错误;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、铁由铁原子构成,故1mol铁中含有的铁原子个数N=nNA=1mol×NA/mol=NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝能溶于强碱溶液 | B. | 铝片能与盐酸反应生成氢气 | ||
| C. | 氯化铝溶液显酸性 | D. | 铝能发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由CuFeS2生成Cu2S,SO2和铁的氧化物反应中硫元素被还原 | |
| B. | 熔炼过程中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 铜的电解精炼过程中纯铜做阳极 | |
| D. | 上述冶炼过程产生大量SO2,通常用饱和NaHSO3溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取试剂瓶中的碳酸钠溶液时,发现取量过多,为了不浪费立即把多余的试剂倒入原试剂瓶中 | |
| B. | 硝酸钡溶于水,故可将含硝酸钡的废液倒入水槽,再用水冲入下水道 | |
| C. | 用蒸发的方法使氯化钠从溶液中析出,应将蒸发皿中的氯化钠溶液全部加热蒸干 | |
| D. | 稀释浓硫酸时,将浓硫酸缓缓注入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2能引起温室效应,是一种大气污染物 | |
| B. | 硫是一种黄色晶体,不溶于水,微溶于酒精 | |
| C. | SO2能使品红溶液褪色是因为它具有漂白性 | |
| D. | NO2和SO2是主要的大气污染物,溶于水后可能形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
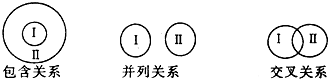
| A. | 电解质与非电解质属于包含关系 | |
| B. | 化合物与碱性氧化物属于包含关系 | |
| C. | 单质与化合物属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
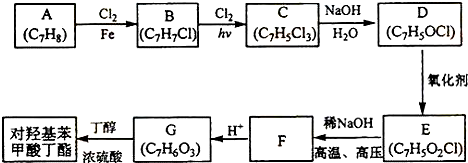
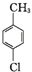 +2Cl2$\stackrel{hv}{→}$
+2Cl2$\stackrel{hv}{→}$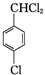 +2HCl,该反应过程中涉及的反应类型是取代反应.
+2HCl,该反应过程中涉及的反应类型是取代反应.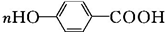 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$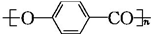 +nH2O.
+nH2O. ,D与银氨溶液发生反应的化学方程式为
,D与银氨溶液发生反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$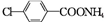 +H2O+2Ag↓+3NH3.
+H2O+2Ag↓+3NH3.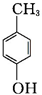 为原料制备G(
为原料制备G(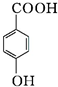 )的合成路线:
)的合成路线: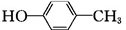 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$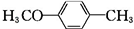 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$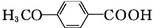 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$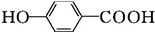 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3 | B. | HCO3- | C. | NH4+ | D. | SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com