
 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
分析 (1)浓度相同的三种溶液,电离平衡常数最小的,氢离子的浓度最小;
(2)相同条件下,体积均为200mL、浓度均为0.1mol•L-1的CH3COOH(aq)和HCl(aq)分别与100mL 0.2mol•L-1NaOH溶液反应,生成等物质的量的水,但醋酸是弱电解质,电离过程中要吸热;
(3)酸根对应的酸越弱(或电离平衡常数越小),则酸根结合氢离子的能力越强;
(4)碳酸的酸性强于次氯酸,而次氯酸的酸性强碳酸氢根离子,所以向次氯酸钠溶液中通入少量二氧化碳,生成次氯酸和碳酸氢钠;
(5)反应速率与氢离子浓度成正比;酸中氢离子浓度越大,反应速率越快,反应时间越短,反应过程中醋酸不断电离;
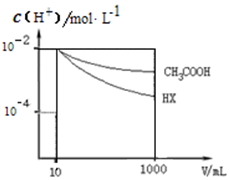
(6)根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数.
解答 解:(1)常温下,若三者体积均为200mL 浓度均为0.1mol•L-1,次氯酸的电离平衡常数最小,所以氢离子的浓度最小,故答案为:次氯酸;
(2)相同条件下,体积均为200mL、浓度均为0.1mol•L-1的CH3COOH(aq)和HCl(aq)分别与100mL 0.2mol•L-1NaOH溶液反应,生成等物质的量的水,但醋酸是弱电解质,电离过程中要吸热,所以醋酸放出热量较少,故答案为:醋酸;
(3)酸根对应的酸越弱(或电离平衡常数越小),则酸根结合氢离子的能力越强,酸性强弱的顺序为:CH3COOH>H2CO3>HClO,所以结合氢离子能力最强的是CO32-,最弱的是醋酸根离子,所以强弱顺序为:CO32->ClO->HCO3->CH3COO-,故答案为:a>b>d>c;
(4)碳酸的酸性强于次氯酸,而次氯酸的酸性强碳酸氢根离子,所以向次氯酸钠溶液中通入少量二氧化碳,生成次氯酸和碳酸氢钠,离子反应方程式为:ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(5)反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间a=b>c,
故答案为:a=b=c;a=b>c;
(6)根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,故答案为:大于.
点评 本题考查酸的电离平衡常数分析解答的问题,题目难度中等,涉及电离程度、中和热、结合质子的能力等知识,试题知识点较多、综合性较强,充分考查学生分析判断能力及化学计算能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | C. | 还原产物 | D. | 氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na投入到水中:Na+H2O═Na++OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2+ | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与硫酸产生氢气多 | B. | 与氢氧化钠溶液产生氢气多 | ||
| C. | 两者产生氢气一样多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 空气污染指数 | 空气质量级别 | 空气质量 |
| 可吸入颗粒物 | 65 | Ⅱ | 良 |
| 二氧化硫 | 6 | ||
| 二氧化氮 | 20 |
| A. | 用氢气作燃料 | B. | 露天焚烧垃圾 | ||
| C. | 大量排放汽车尾气 | D. | 用煤作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.0g | B. | 19.2g | C. | 40.0g | D. | 80.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、SO42-、CO32- | B. | K+、Fe2+、SO42-、MnO4- | ||
| C. | Ba2+、K+、Al3+、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com