
已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有 ;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是 ;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示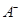 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。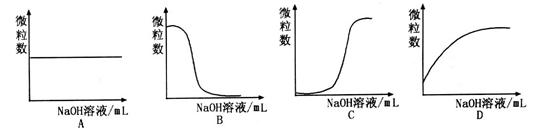
(2)现将1体积0.04mol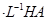 溶液和1体积0.02mol
溶液和1体积0.02mol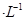 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其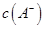 0.01 mol
0.01 mol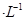 (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是 。
(1)①H2O、HA、H+、Na+、OH?、A-(2分,有错不得分)
②A-+H+ HA(2分,不写可逆号也可)
HA(2分,不写可逆号也可)
③D(1分)
(2)①<(1分)
②c(A-)>c(Na+)>c(H+)>c(OH?)(2分)
解析试题分析:(1)①溶液中的微观粒子既包括离子,也包括分子,所以含有HA和其钠盐NaA的溶液的微观粒子有:H2O、HA、H+、Na+、OH?、A-
②加入少量盐酸,HCl与NaA反应生成HA,所以离子方程式为:A-+H+ HA
HA
③溶液含有HA和NaA,逐滴加入NaOH溶液,HA与NaOH反应生成NaA和H2O,所以A2-数目逐渐增大,故D项正确。
(2)①1体积0.04mol/LHA溶液和1体积0.02mol/LNaOH溶液混合,HA过量,得到等量的NaA和HA,若该混合液显碱性,则c(H+)<c(OH?),根据电荷守恒c(H+)+c(Na+)=c(OH?)+c(A-)可得c(A-)<0.01mol?L?1。
②若该混合液显酸性,则HA的电离程度大于NaA的水解程度,溶液中所有离子的浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH?)
考点:本题考查盐类的水解、弱电解质的电离、离子浓度比较。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
(14分)(1)常温时,将浓度为m mol· L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m n(填“>”、“<”或“=”,下同);若将PH=2的CH3COOH溶液和PH=12的NaOH溶液等体积混合,混合溶液的PH 7
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时KSP[Cu(OH)2]= 2.2×10-20,将Cu(OH)2溶于2.2mol/LCuCl2溶液中形成平衡,溶解平衡方程式为 ,溶液的PH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl
⑥NH3·H2O。c(NH4+)由小到大的排列顺序是 (填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 |
| C.Na2CO3 | D.NH3·H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是 ;反应过程中放出H2的速率依次为va、vb、vc,则其关系是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 H++B2-。
H++B2-。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是 。
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C.溶液中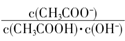 不变
不变
D溶液中 减小
减小
(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.lmol/L的下列五种溶液的PH值如表所示:
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。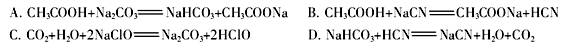
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度 离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在a mL醋酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,滴定曲线如图所示。
(1)醋酸溶液浓度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b点,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在____;
A.2与a之间 B.a与b之间
C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是________。
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是 。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是 (用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是 ,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com