
【题目】在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
【答案】D
【解析】试题分析:A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14mol2L-2,故A错误;B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7molL-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:K=![]() =(n-1)×10-7,故D正确;故选D。
=(n-1)×10-7,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图1、2、3为三套实验装置。

(1)图中所示仪器①和③的名称分别是_____________、_____________。
(2)图1装置可用于少量蒸馏水的制取,需要在仪器①中加入碎瓷片,目的是___________________;仪器②中冷却水的入口是__________(填“a”或“b”);图3装置也可用于少量蒸馏水的制取(加热及固定仪器略),该装置中使用的玻璃导管较长,其作用是____________。
(3)若用CCl4从碘水中萃取I2并用图2装置进行分离,振荡后静置观察到的现象是___________________________________________________________;在用图2装置进行分液操作时,为使液体顺利滴下,应进行的具体操作是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________。
②电解NaCl溶液的离子方程式是____________________________________________。
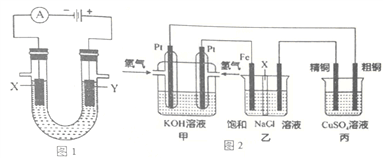
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________。
②石墨电极(乙装置中右侧电极)为__________极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________L;丙装置中阴极析出铜的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 酸性KI淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O
D. Na2S溶液使酚酞试液变红:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的能量图,下列说法正确的是

A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 1molA2(g)和1molB2(g)的能量之和为akJ
D. 2AB(g)=A2(l)+B2(l)△H<(b-a)kJ/mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.03×1023个NH3含_________mol氨分子,_________mol氢原子,__________mol质子,________个电子,在标准状况下的体积为______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣(主要成分为Ca(OH)2和CaCO3)为原料制备KClO3的流程如下:

下列说法不正确的是
A. 氯化过程中主反应为:6Ca(OH)2+6Cl2= Ca(ClO3)2+5CaCl2+6H2O
B. 适当减缓通Cl2速率,充分搅拌浆料,加水使Ca(OH)2完全溶解,均有利于氯气的吸收
C. 滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]=1:5
D. 向滤液中加入稍过量KC1固体可将Ca(ClO3)2转化为KClO3,通过蒸发浓缩、冷却结晶的方法析出KClO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。

(1)甲池中OH-移向__________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式_______________。
(3)乙池中总反应的离子方程式___________________。
(4)当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com