
| A. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)>c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
分析 A.根据溶液中氢离子浓度c(H+)=10-pH进行计算;
B.碳酸氢钠是强碱弱酸酸式盐,谁弱谁水解,谁强谁显性,所以碳酸氢根离子易水解;
C.任何溶液中都遵循电荷守恒;
D.根据水的离子积常数计算氢氧根离子浓度.
解答 解:A.pH=4的醋酸中的c(H+)=10-pH=10-4mol/L,故A错误;
B.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子易水解,而钠离子不水解,所以溶液中存在:c(Na+)>c(HCO3-),故B错误;
C.氯化钠溶液呈电中性,阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(Cl-)+c(OH-),故C正确;
D.水的离子积常数与温度有关,温度升高,水的电离程度增大,水的离子积常数增大,50℃下,水的离子积常数大于10-14,所以pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol•L-1,故D错误;
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,根据电荷守恒、物料守恒来分析离子浓度大小,易错选项是D,注意水的离子积常数与温度的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 常温下将5mL 0.1 mol/LNa2S2O3溶液、5mL 0.01 mol/LNa2S2O3溶液分别与5mL 0.1 mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中SO2、O2、SO3共存 | B. | 容器中SO2 和SO3浓度相同 | ||
| C. | 容器中n(SO2):n(O2):n(SO3)=2:1:2 | D. | 容器中压强不随时间而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠可用于呼吸面具中作为氧气的来源 | |
| B. | 氧化还原反应的实质是元素化合价是否变化 | |
| C. | 铁制容器可以贮运稀硝酸 | |
| D. | 雷电为自然界固氮提供了条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| B. | 常温下,铁、铝在浓硝酸中钝化 | |
| C. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 | |
| D. | 夏天,打开冰镇汽水瓶,立即冒出大量泡沫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
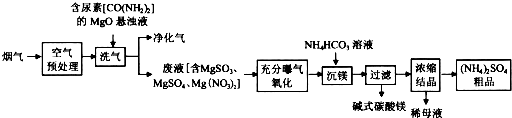
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com