
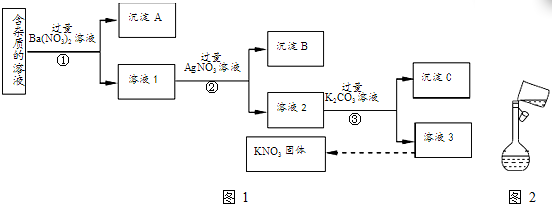
·ÖĪö ĄūÓĆŗ¬ÉŁĮæKCl”¢K2SO4”¢K2CO3ŌÓÖŹµÄKNO3ČÜŅŗ£¬µĆµ½“æ¾»µÄKNO3¹ĢĢ壬ÓÉĮ÷³ĢæÉÖŖ£¬¢ŁÖŠ¼Ó¹żĮæµÄĻõĖį±µ£¬ÓėK2SO4”¢K2CO3·“Ӧɜ³É³ĮµķAĪŖBaSO4”¢BaCO3£¬ĀĖŅŗÖŠŗ¬KCl”¢ĻõĖį±µ”¢KNO3£¬¢ŚÖŠÓė¹żĮæĻõĖįŅų·“Ӧɜ³ÉAgCl³Įµķ£¬ČÜŅŗ2ÖŠŗ¬ĻõĖį±µ”¢ĻõĖįŅų”¢ĻõĖį¼Ų£¬¢ŪÖŠÓė¹żĮæĢ¼Ėį¼Ų·“Ӧɜ³ÉĢ¼Ėį±µ”¢Ģ¼ĖįŅų³Įµķ£¬ČÜŅŗ3ÖŠŗ¬ĻõĖį¼Ų”¢Ģ¼Ėį¼Ų£¬Ó¦¼ÓĻõĖįŌŁÕō·¢½į¾§”¢¹żĀĖµĆµ½ĻõĖį¼Ų£¬ÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄČÜŅŗŹ±£¬ŅŖÓƵ½²£Į§°ō”¢ÉÕ±”¢ČŻĮæĘ棬ŌŚ×ŖŅĘČÜŅŗŹ±£¬ŅŖÓĆ²£Į§°ōŅżĮ÷£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗĄūÓĆŗ¬ÉŁĮæKCl”¢K2SO4”¢K2CO3ŌÓÖŹµÄKNO3ČÜŅŗ£¬µĆµ½“æ¾»µÄKNO3¹ĢĢ壬ÓÉĮ÷³ĢæÉÖŖ£¬¢ŁÖŠ¼Ó¹żĮæµÄĻõĖį±µ£¬ÓėK2SO4”¢K2CO3·“Ӧɜ³É³ĮµķAĪŖBaSO4”¢BaCO3£¬ĀĖŅŗÖŠŗ¬KCl”¢ĻõĖį±µ”¢KNO3£¬¢ŚÖŠÓė¹żĮæĻõĖįŅų·“Ӧɜ³ÉAgCl³Įµķ£¬ČÜŅŗ2ÖŠŗ¬ĻõĖį±µ”¢ĻõĖįŅų”¢ĻõĖį¼Ų£¬¢ŪÖŠÓė¹żĮæĢ¼Ėį¼Ų·“Ӧɜ³ÉĢ¼Ėį±µ”¢Ģ¼ĖįŅų³Įµķ£¬ČÜŅŗ3ÖŠŗ¬ĻõĖį¼Ų”¢Ģ¼Ėį¼Ų£¬Ó¦¼ÓĻõĖįŌŁÕō·¢½į¾§”¢¹żĀĖµĆµ½ĻõĖį¼Ų£¬
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬³ĮµķAÖŠŗ¬BaSO4”¢BaCO3£¬¹Ź“š°øĪŖ£ŗBaSO4£»BaCO3£»
£Ø2£©¢Ū·ÖĄė²»ČÜŠŌ¹ĢĢåÓėČÜŅŗ£¬½ųŠŠµÄŹµŃé²Ł×÷ŹĒ¹żĀĖ£¬¹Ź“š°øĪŖ£ŗ¹żĀĖ£»
£Ø3£©¢Ū¼ÓČė¹żĮæµÄK2CO3ČÜŅŗµÄÄæµÄŹĒ³żČ„Ba2+”¢Ag+£¬¹Ź“š°øĪŖ£ŗ³żČ„Ba2+”¢Ag+£»
£Ø4£©ĪŖĮĖ³żČ„ČÜŅŗ3ÖŠµÄŌÓÖŹ£¬æÉĻņĘäÖŠ¼ÓČėŹŹĮæµÄĻ”ĻõĖį£®“Ó“ĖČÜŅŗ»ńµĆKNO3¾§ĢåµÄ²Ł×÷ŹĒÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ£¬
¹Ź“š°øĪŖ£ŗĻ”ĻõĖį£»Õō·¢ÅØĖõ£»ĄäČ“½į¾§£»
£Ø5£©ŹµŃéŹŅÓĆÉĻŹöŹµŃé»ńµĆµÄKNO3¹ĢĢåÅäÖĘ500mL0.40mol/LKNO3ČÜŅŗ£®
¢ŁÅäÖĘ500mL0.40mol/LKNO3ČÜŅŗ£¬ŠčŅŖKNO3¹ĢĢåµÄÖŹĮæĪŖ0.5L”Į0.40mol/L”Į101g/mol=20.2g£¬
¹Ź“š°øĪŖ£ŗ20.2£»
¢ŚÄ³Ķ¬Ń§×ŖŅĘČÜŅŗµÄ²Ł×÷ČēĶ¼ĖłŹ¾£¬Ķ¼ÖŠÓƵ½µÄŅĒĘ÷ŹĒÉÕ±ŗĶ 500mLČŻĮæĘ棬øĆĶ¬Ń§²Ł×÷ÖŠµÄ“ķĪóŹĒŌŚ×ŖŅĘČÜŅŗŹ±£¬Ć»ÓŠÓĆ²£Į§°ōŅżĮ÷£¬
¹Ź“š°øĪŖ£ŗ500mLČŻĮæĘæ£»Ć»ÓŠÓĆ²£Į§°ōŅżĮ÷£®
µćĘĄ ±¾Ģāæ¼²é»ģŗĻĪļ·ÖĄėĢį“棬ĪŖøßĘµæ¼µć£¬°ŃĪÕĮ÷³ĢÖŠµÄ·“Ó¦”¢»ģŗĻĪļ·ÖĄė·½·ØĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®


 ¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø
¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø Ó¢²Å¼Ę»®Ķ¬²½æĪŹ±øߊ§ŃµĮ·ĻµĮŠ“š°ø
Ó¢²Å¼Ę»®Ķ¬²½æĪŹ±øߊ§ŃµĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.7g | B£® | 8.1g | C£® | 5.4g | D£® | 10.8g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “×Ėįļ§ | B£® | ĮņĖį±µ | C£® | ĮņĒč»ÆĢś | D£® | µā»ÆĒā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 øÖĢś¹¤ŅµŹĒ¹ś¼Ņ¹¤ŅµµÄÖ§Öł£¬ĆæÄźøÖĢśÉśŠāČĆ¹ś¼ŅĖšŹ§“óĮæ׏½š£¬Ēė»Ų“šøÖĢśøÆŹ“Óė·Ą»¤¹ż³ĢÖŠµÄÓŠ¹ŲĪŹĢā£®
øÖĢś¹¤ŅµŹĒ¹ś¼Ņ¹¤ŅµµÄÖ§Öł£¬ĆæÄźøÖĢśÉśŠāČĆ¹ś¼ŅĖšŹ§“óĮæ׏½š£¬Ēė»Ų“šøÖĢśøÆŹ“Óė·Ą»¤¹ż³ĢÖŠµÄÓŠ¹ŲĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | BaCl2ČÜŅŗ | B£® | FeCl2ČÜŅŗ | C£® | FeCl3ČÜŅŗ | D£® | Fe£ØNO3£©2ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com