
| Kw |
| c(OH-) |
| 0.005mol-0.0045mol |
| 0.5L |
| 10-14 |
| 0.001 |


科目:高中化学 来源: 题型:
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12 L氢气 |
| B、1.12 L氧气 |
| C、2.24 L氢气 |
| D、2.24 L氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
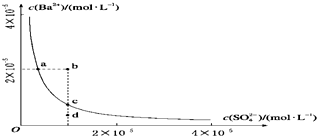
| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌片是负极,铜片上有气泡冒出 |
| B、电流方向是从锌片流向铜片 |
| C、溶液中硫酸的物质的量不变 |
| D、电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2是生产光导纤维和粗硅的主要原料 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、SiO2与CO2都属于酸性氧化物,都不能与酸反应 |
| D、水晶的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2含有分子数为0.5NA |
| B、在常温常压下,22.4LNe含有原子数为NA |
| C、71gCl2所含有的原子数为2NA |
| D、在同温同压下,相同体积的气体单质含有原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com