
(10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是 mol,SO42—的物质的量是 mol,所含O原子的数目是 个。
(10分,每空1分)(1)62g/mol 62 16 Na2O (2)34-m (3)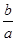 NA
NA
(4)108g/mol (5)3 1.5 21NA
【解析】考查物质的量的有关计算。
(1)12.4 g Na2X含有0.4 mol Na+,则化合物的物质的量是0.2mol,所以该化合物的摩尔质量是12.4g÷0.2mol=62g/mol;其相对分子质量是62,X的相对分子质量是62-23×2=16,所以X是O,则该化合物是Na2O。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则 ,解得M=34,所以X原子的相对原子质量是34-m。
,解得M=34,所以X原子的相对原子质量是34-m。
(3)根据M=m/n和 可知,X的相对原子质量可表示为
可知,X的相对原子质量可表示为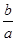 NA。
NA。
(4)根据质量守恒定律可知,E物质的质量是20g+14g-8.8g-3.6g=21.6g,所以E的摩尔质量是21.6g÷0.2mol=108g/mol。
(5)483 g Na2SO4·10H2O的物质的量是483g÷322g/mol=1.5mol,则钠离子的物质的量是3.0mol,SO42-的物质的量是1.5mol。氧原子的物质的量是14×1.5mol=21mol,原子数个数是21NA。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:物理教研室 题型:058

为确定其结构,应利用物质的特殊性质进行定性、定量实验.现给出乙醇、钠反应装置图(下图),请回答下列问题:

(1)学生甲得到一组实验数据:
|
乙醇的物质的量 |
氢气的体积(标准状况) |
|
0.10 mol |
1.12 L |
根据以上数据推断乙醇的结构应为________(用Ⅰ、Ⅱ表示),理由为________________.
(2)学生乙分别准确称量4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况后都小于1.12 L.如果忽略量筒本身及读数造成的误差,那么学生乙认为是由于样品乙醇中含有少量水造成的,你认为正确吗?答:___________(填“正确”或“不正确”).如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?答:___________.
(3)学生丙认为实验成功的关键有:①装置气密性良好;②实验开始前准确确定乙醇的量;③钠足量;④广口瓶内必须充满水;⑤氢气的体积的测算方法正确、数值准确.其中正确的有___________(填序号).
(4)学生丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是________________________________.
(5)实验后四名学生从乙醇的可能结构分析入手对乙醇和钠的关系进行讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量取值要求必须是_____________________.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058

为确定其结构,应利用物质的特殊性质进行定性、定量实验.现给出乙醇、钠反应装置图(下图),请回答下列问题:

(1)学生甲得到一组实验数据:
|
乙醇的物质的量 |
氢气的体积(标准状况) |
|
0.10 mol |
1.12 L |
根据以上数据推断乙醇的结构应为________(用Ⅰ、Ⅱ表示),理由为________________.
(2)学生乙分别准确称量4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况后都小于1.12 L.如果忽略量筒本身及读数造成的误差,那么学生乙认为是由于样品乙醇中含有少量水造成的,你认为正确吗?答:___________(填“正确”或“不正确”).如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?答:___________.
(3)学生丙认为实验成功的关键有:①装置气密性良好;②实验开始前准确确定乙醇的量;③钠足量;④广口瓶内必须充满水;⑤氢气的体积的测算方法正确、数值准确.其中正确的有___________(填序号).
(4)学生丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是________________________________.
(5)实验后四名学生从乙醇的可能结构分析入手对乙醇和钠的关系进行讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量取值要求必须是_____________________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省四校高一零班第一次月考化学试卷(带解析) 题型:计算题
(10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是 mol,SO42—的物质的量是 mol,所含O原子的数目是 个。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都七中实验学校高一上学期期中考试化学试卷 题型:填空题
(10分)以下12种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩Fe(OH)3 ?NaOH ?NH3·H2O
请按下列分类标准回答问题。
(1)属于电解质的是__________________________。
(2)能电离出H+的是______ __。
(3)属于碱的是________________,其中属于难溶性碱的是____ ____。
(4)属于难溶性盐的是__ _____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com