

分析 硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,判断焙砂的主要成分;
(2)焙烧生成的含硫氧化物可转换为硫酸;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而出去Fe;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,据此判断产物;
(5)依据题意“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,可知反应物中含有H+和O2,可以获得非金属单质S,据此写出方程式;
(6)由题意可知:反应物为ZnCO3和C,产物含有Zn,根据反应物和生成物写出化学方程式.
解答 解:(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO,故答案为:ZnO;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作,故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而出去Fe,故答案为:Zn粉;置换出Fe等;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,产物为O2,故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,化学方程式为2ZnS+4H++O2=2Zn2++2S↓+2H2O,故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)由题意可知:反应物为ZnCO3和C,产物含有Zn,化学方程式:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑;
故答案为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
点评 本题为工艺流程题,通过锌的炼制考查了化学方程式、离子方程式的书写,明确工艺流程及各种物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
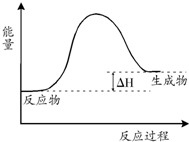
| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,混合气体的颜色变浅 | |
| C. | 反应体系中加入催化剂对反应热是有影响 | |
| D. | 在反应体系中加入催化剂,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g | B. | 32 g | C. | 1.5mol | D. | 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
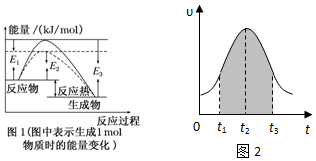
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30.5 | B. | 26.3 | C. | 26 | D. | 24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
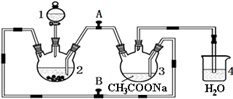 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

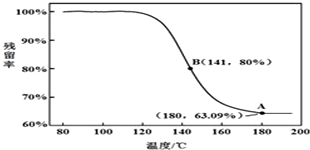
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com