

| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
 拌溶液,在石棉网上加热至沸腾.
拌溶液,在石棉网上加热至沸腾. +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$ +2 MnO2↓+H2O+1KOH
+2 MnO2↓+H2O+1KOH分析 I.(1)甲苯不溶于水会分层,反应生成的苯甲酸钾易溶于水;装置a能冷凝回流蒸汽;甲苯与高锰酸钾反应生成苯甲酸钾、二氧化锰、水和氢氧化钾,根据元素守恒配平方程式;
II.(1)亚硫酸氢钠均有还原性,能还原高锰酸钾;
(2)过滤除去难溶性的二氧化锰,趁热过滤可以防止苯甲酸钾结晶析出;
(4)苯甲酸中的杂质为氯化钾,根据二者物理性质的差别分析;
III.苯甲酸与氢氧化钾反应生成苯甲酸钾,苯甲酸钾水解显碱性,应该用酚酞作指示剂;根据氢氧化钾的物质的量求出苯甲酸的物质的量,再求出质量和质量分数;
解答 解:I.(1)甲苯不溶于水会分层,反应生成的苯甲酸钾易溶于水,所以反应后的混合溶液不再分层,说明甲苯完全反应;装置a能冷凝回流水蒸汽、甲苯蒸汽,防止甲苯的挥发而降低产品产率;甲苯与高锰酸钾反应生成苯甲酸钾、二氧化锰、水和氢氧化钾,反应方程式为: +2KMnO4$\stackrel{加热}{→}$
+2KMnO4$\stackrel{加热}{→}$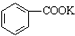 +2MnO2↓+H2O+KOH;
+2MnO2↓+H2O+KOH;
故答案为:分层;将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率;2;2;1KOH;
II.(1)亚硫酸氢钠均有还原性,能还原高锰酸钾生成二氧化锰、硫酸钾和水,其反应的离子方程式为:OH-+HSO3-=SO32-+H2O、2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-,亚硫酸氢钠具有还原性,可以用乙二酸或者乙二酸钠代替,
故答案为:OH-+HSO3-=SO32-+H2O、2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-;乙二酸或者乙二酸钠;
(2)反应后的混合物中含有二氧化锰固体,过滤除去难溶性的二氧化锰,
故答案为:除去二氧化锰并回收二氧化锰表面附着的产品;
(4)苯甲酸中的杂质为氯化钾,苯甲酸易升华,KCl的熔沸点很高,不升华,所以提纯含有氯化钾的苯甲酸可以采用升华的方法;苯甲酸在水中的溶解度受温度影响较大,可以采用重结晶的方法提纯苯甲酸;
故答案为:BD;
III.苯甲酸与氢氧化钾反应生成苯甲酸钾,苯甲酸钾水解显碱性,应该用在碱性条件下变色的指示剂,所以选用酚酞作指示剂;
n(KOH)=cV=0.1000mol•L-1 ×0.024L=0.0024mol,苯甲酸与氢氧化钾等物质的量恰好反应,则n(苯甲酸)=0.0024mol,
则其总质量为0.0024mol×122g/mol×$\frac{100ml}{25ml}$=1.1712g,所以产品中苯甲酸质量分数为$\frac{2.40×1{0}^{-3}×122×4}{1.22}$=$\frac{1.1712g}{1.22g}$×100%=96.00%,
故答案为:酚酞;$\frac{2.40×1{0}^{-3}×122×4}{1.22}$;96.00%.
点评 本题考查了苯甲酸的制备实验方案设计,侧重于制备实验操作、物质的分离提纯、离子方程式的书写、数据的处理和计算、滴定原理的应用等知识点的考查,清楚制备的原理是解答的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| C. | 氢氧化铝与足量盐酸反应Al(OH)3+3H+═Al3++3H2O | |
| D. | 少量CO2通入氢氧化钠溶液中CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2的电离方程式:CaCl2═Ca2++2Cl- | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | 氟的原子结构示意图: | |
| D. | 次氯酸的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液 | |
| B. | 发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护 | |
| C. | 氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化学腐蚀 | |
| D. | 三氯化氮分子是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B 两元素形成的最高价氧化物对应水化物的酸性应:A强于B | |
| B. | A的气态氢化物比B的气态氢化物稳定 | |
| C. | A的原子序数一定小于B的原子序数 | |
| D. | A的阴离子比B的阴离子还原性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④⑧ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{84}^{210}$Po与${\;}_{84}^{209}$Po互为同素异形体 | |
| B. | ${\;}_{84}^{210}$Po与${\;}_{84}^{209}$At互为同位素 | |
| C. | ${\;}_{84}^{210}$Po与${\;}_{84}^{209}$Po在元素周期表中占有相同的位置 | |
| D. | 钋元素的相对原子质量为210 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com