
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
分析 实验一:(1)根据表中数据可知,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;影响反应速率的还有温度,所以应该使反应温度相同;
(2)根据图示装置及选取的试剂可知,实验目的是通过测定反应生成氢气快慢进行判断浓度对反应速率的影响;
实验二:利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得,物质的能量越低越稳定.
解答 解:实验一:(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响;温度对化学反应速率的影响较大,故根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同,
故答案为:探究反应物本身的性质对反应速率的影响,温度相同;
(2)根据装置图可知,该实验目的是通过测量生成气体的量来研究浓度对反应速率的影响,用大小形状相同的Fe分别和0.5mol/L 及2mol/L的足量稀硫酸反应,通过测定和比较同时间内产生氢气的体积,可以说明浓度对化学反应速率的影响,
故答案为:测定和比较同时间内产生氢气的体;
实验二:已知:P4(s,白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ•mol-1 ①,
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②,
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1,说明这是一个放热反应,所以相同状况下,白磷比红磷能量高,因为能量越低越稳定,所以红磷比白磷稳定,
故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1; 红磷; 低.
点评 本题探究化学反应速率的影响因素,注意控制变量,外界条件有温度、浓度、压强、催化剂等,外界条件只是影响反应速率,决定化学反应速率的是物质本身的性质,注意盖斯定律的灵活运用,题目难度中等.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O晶体与氯化铵固体的反应 | |
| B. | 氢氧化钠溶液与盐酸反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | 高温煅烧石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Br的非金属性比Se强 | |
| D. | 气态氢化物的还原性比硫化氢气体弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为1.8NA | B. | 分子数为0.1NA | C. | 中子数为2NA | D. | 原子数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
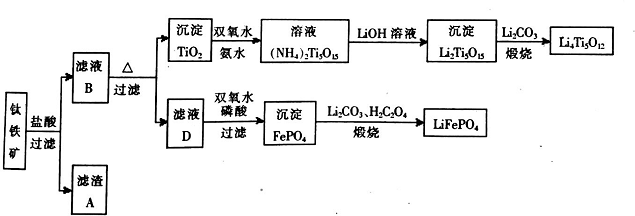
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
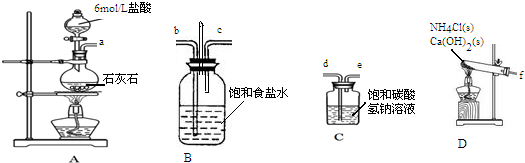 制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.
制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.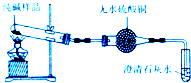
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、还原、取代、加成、聚合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com