
分析 (1)同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,金属与水反应越剧烈;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小;
(3)氧化铝属于两性氧化物,能溶于强酸又能溶于强碱;
(4)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,对应氢化物越稳定;
(5)金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,Na的金属性最强,与水反应最最剧烈,故答案为:Na;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小,故答案为:H;
(3)Al2O3属于两性氧化物,能溶于强酸又能溶于强碱,故答案为:Al2O3;
(4)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,F元素非金属性最强,非金属性越强,对应氢化物越稳定,故HF最稳定,故答案为:HF;
(5)Na的金属性最强,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH碱性最强,故答案为:NaOH.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意对元素周期律的理解掌握,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A. | 高温会导致碘的损失 | B. | 碘酸钾可氧化氯化钠 | ||
| C. | 可用淀粉检验碘盐中的碘酸钾 | D. | 该碘盐中碘含量是指碘酸钾的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
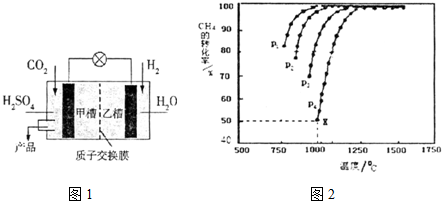 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ | |
| B. | Al13超原子中Al原子间是通过共价键结合的 | |
| C. | Al14、Al13性质与Al相似,都具有较强的还原性 | |
| D. | Al13和Al14互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1NaCl溶液 | B. | 75mL 1mol•L-1 CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHSO3溶液中:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>C(OH-) | |
| B. | 0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,在混合溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 等体积、等浓度的HR溶液和NaOH溶液混合,溶液中一定存在:c(Na+)>c(R-)>c(OH-)>c(H+) | |
| D. | 等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中离子总数:②>①>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com