
【题目】1L某混合溶液,只可能含有下表中的若干种离子:
可能大量含有的阳离子 |
|
可能大量含有的阴离子 |
|
当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是![]()
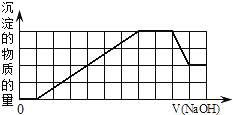
A.原溶液中加入盐酸有沉淀生成
B.原溶液中一定含有![]() 和
和![]()
C.反应最后得到的沉淀只有![]()
D.反应最后形成的溶液中溶质只有![]()
【答案】C
【解析】
开始时加入1体积氢氧化钠溶液后没有生成沉淀,说明溶液中一定存在氢离子或碳酸根离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在![]() ,所以溶液中一定不存在
,所以溶液中一定不存在![]() ,则一定存在
,则一定存在![]() 离子,
离子,![]() 能够与氢离子反应,则一定不存在
能够与氢离子反应,则一定不存在![]() ;生成沉淀消耗了6体积氢氧化钠,溶液中可能存在生成沉淀的离子:
;生成沉淀消耗了6体积氢氧化钠,溶液中可能存在生成沉淀的离子:![]() 、
、![]() 、
、![]() ,根据最后阶段部分沉淀溶解可知,溶液中一定存在
,根据最后阶段部分沉淀溶解可知,溶液中一定存在![]() ,根据图象氢氧化铝沉淀的物质的量与剩余的沉淀的物质的量相等,由
,根据图象氢氧化铝沉淀的物质的量与剩余的沉淀的物质的量相等,由![]() 可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3体积氢氧化钠,则另一种离子生成的沉淀的量与消耗的氢氧化钠与铝离子相同,说明另一种离子应该为
可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3体积氢氧化钠,则另一种离子生成的沉淀的量与消耗的氢氧化钠与铝离子相同,说明另一种离子应该为![]() 价离子,只能为
价离子,只能为![]() 离子,故原溶液中一定不存在
离子,故原溶液中一定不存在![]() 、
、![]() 、
、![]() ; 再由沉淀的物质的量达到最大后氢氧化铝没有溶解,说明加入的氢氧化钠溶液与
; 再由沉淀的物质的量达到最大后氢氧化铝没有溶解,说明加入的氢氧化钠溶液与![]() 发生了反应,即溶液中一定存在
发生了反应,即溶液中一定存在![]() ; 再根据溶液呈电中性可知,溶液中至少存在
; 再根据溶液呈电中性可知,溶液中至少存在![]() 、
、![]() 中的1种离子, 根据以上分析可知,原溶液中一定存在的离子为:
中的1种离子, 根据以上分析可知,原溶液中一定存在的离子为:![]() 、
、![]() 、
、![]() 、
、![]() ;一定不存在的离子为:
;一定不存在的离子为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;可能存在的离子为:
;可能存在的离子为:![]() ;至少存在
;至少存在![]() 、
、![]() 中的1种离子。
中的1种离子。
根据上述分析可知,
A.原溶液中不存在偏铝酸根离子,加入盐酸不会生成沉淀,故A错误;
B.根据分析可知,溶液中至少存在![]() 、
、![]() 中的至1种离子,不一定都存在,故B错误;
中的至1种离子,不一定都存在,故B错误;
C.根据分析可知,生成的沉淀为氢氧化铝和氢氧化铁的混合物,加入过量氢氧化钠溶液后氢氧化铝沉淀溶解,剩余的沉淀为![]() ,故C正确;
,故C正确;
D.原溶液中一定存在阴离子,为![]() 、
、![]() 中的1种离子,所以最后的溶质不是只有偏铝酸钠,故D错误。
中的1种离子,所以最后的溶质不是只有偏铝酸钠,故D错误。
故选C。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸(H2C2O4)的反应,记录如表所示的实验数据:
实验 | 实验 | 试管中所加试剂及其用量/mL | 溶液褪至无 | |||
编号 | 温度 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | 色所需时间 /min |
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式 ______,当该反应以表中数据反应完全时转移电子数为NA。
(2)V1=_______mL。
(3)根据表中的实验①、②数据,可以得到的结论是 _______。
(4)探究温度对化学反应速率的影响,应选择 _______(填实验编号)
实验编号 | 实温度 /℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间/min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
(5)该小组根据经验绘制了 n (Mn 2+)随时间变化的趋势如图 1 所示,但有同学查阅已有实验资料发现,该实验过程中 n (Mn 2+)随时间变化的实际趋势如图 2 所示。
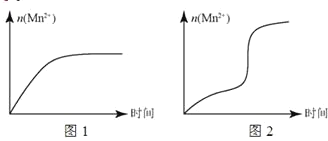
该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
②小组同学提出的假设是________。
②若该小组同学提出的假设成立,应观察到________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(分子式 N2H4,沸点 113.5℃)是一种良好的火箭燃料,是一种易溶 于水和醇类等有机溶剂的无色油状液体。在工业上有重要用途。实验室可用如下 装置(略去部分夹持装置)模拟利用氨气和次氯酸钠合成肼的过程。

(1)装置 A 可用来制备 Cl2,装置 B 中饱和食盐水的作用是_____,当合成肼的反应结束时关闭止水夹 K1,装置 B 可以观察到的实验现象_____。
(2)装置 C 中长玻璃导管 b 与装置 B 中的_____(填仪器名称)的作用相同。
(3)装置 E 中可用熟石灰和氯化铵制备 NH3,反应的化学方程式为_____
(4)当反应一段时间,关闭两个止水夹,打开装置 C 中分液漏斗的活塞,将溶液 全部滴入集气瓶中,反应生成肼。反应的离子方程式为_____。 有同学说装置 D 没有什么作用,若去掉装置 D,对实验是否有影响?请说明理由:___________。
(5)将足量的 Cl2 与含有 0.4mol NaOH 的水溶液反应,分液漏斗中液体全部滴入 C 中,并向 C 中通入标准状况下的 13.44L NH3,从 C 中蒸馏分离得到 3.6g 液态肼, 则该实验中肼的实验产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 、Cl
、Cl![]() 、
、![]() 六种离子中的几种.现进行下列实验:
六种离子中的几种.现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深.
据此可以推断,该溶液中肯定不存在的离子是![]()
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂,它能将工厂排放的CO)以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充有Na2CO3溶液,其原理如图所示。

(1)这种微胶囊吸收CO2的原理是 ____用离子方程式表示),此过程是_____填“吸收”或“放出”)能量的过程。
(2)在吸收过程中下列关于胶囊内溶液的说法正确的是 ___(填字母)。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
(4)在体积为2L的恒容容器中发生反应:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)。当投料为1 mol CO2(g)和3molH2 (g)时,测得温度对CO2平衡转化率的影响为曲线a,改变投料比![]() 测量后得到曲线b。
测量后得到曲线b。
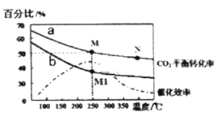
①根据曲线a计算250℃时该反应的化学平衡常数K= ____代入数值列出计算式即可)。
②b条件下投料比![]() ____(填“>” “<”或“=”)3,判断依据是 __ 。
____(填“>” “<”或“=”)3,判断依据是 __ 。
③下列说法正确的是 ___(填字母)。
A.平衡常数大小:M>N>M1
B.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
C.当压强、混合气体的密度或![]() 不变时均可视为化学反应已达到平衡状态
不变时均可视为化学反应已达到平衡状态
D.工业生产中采取较高温度(250℃左右)是为了提高催化剂活性加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长.工业上用邻异丙基苯酚合成叶蝉散的过程如下:

下列有关说法正确的是( )
A.叶蝉散的分子式是C11H16NO2
B.邻异丙基苯酚发生了取代反应
C.叶蝉散在强酸、强碱性环境中能稳定存在
D.可用FeCl3检验叶蝉散中是否含邻异丙基苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号),抗酸药的成分Al(OH)3中和胃酸过多的离子方程式为___。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号,下同)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___。
(4)阿司匹林药品标签上贴有OTC,它表示___, 滥用药物会导致不良后果,如过量服用___会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取两份100mL的该溶液进行如下实验:
,现取两份100mL的该溶液进行如下实验:
(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL;
(2)第二份加足量![]() 溶液,得沉淀
溶液,得沉淀![]() ,再用足量盐酸洗涤、干燥后,沉淀质量为
,再用足量盐酸洗涤、干燥后,沉淀质量为![]() .
.
根据上述实验,下列推测正确的是![]()
A.![]() 一定存在
一定存在
B.100mL该溶液中含![]()
C.![]() 不一定存在
不一定存在
D.![]() 不确定,可向原溶液中加入
不确定,可向原溶液中加入![]() 溶液进行检验
溶液进行检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉末(主要成分MnO2,还含有Al2O3、Fe2O3等杂质)为原料制MnSO4·H2O的工艺流程如下:
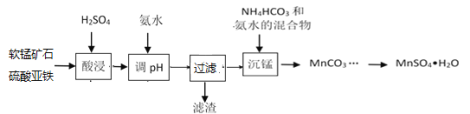
已知:pH>3.3后溶液不存在Fe3+,pH>5.0后溶液不存在Al3+,pH>8后Mn2+开始沉淀。
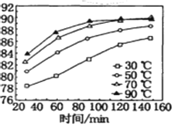
(1)保持其他条件不变,在不同温度下对含软锰矿粉进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。
(2)“酸浸”时,会将Fe2+氧化至Fe3+,所发生的反应离子方程式为__________。
(3)酸浸时要加入硫酸,硫酸浓度不能过大或者过小。当硫酸浓度过小时,酸浸会有红褐色残渣出现,原因是_____________________________。
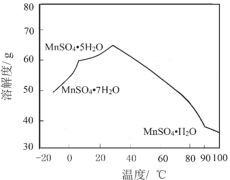
(4)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com