
【题目】下图是表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。
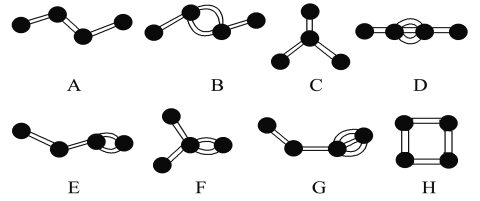
(1)图中属于烷烃的是________(填字母)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成______和______;不仅可以形成________,还可以形成碳环。
(3)上图中互为同分异构体的是:A与________;B与________;D与________(填字母)
(4)写出图中C物质结构简式:____________________。
【答案】 A、C 碳碳双键 碳碳三键 碳链 C E、F、H G CH(CH3)3
【解析】根据物质的球棍模型可知A是丁烷,B是2-丁烯,C是异丁烷,D是2-丁炔,E是1-丁烯,F是2-甲基-1-丙烯,G是1-丁炔,H是环丁烷,据此解答。
(1)烃分子中碳原子之间以单键相结合,剩余价键全部与氢原子结合,使每个碳原子的化合价都达到饱和,烷烃又叫饱和链烃,因此图中属于烷烃的是丁烷、异丁烷,答案选AC。
(2)根据模型可知在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成碳碳双键和碳碳三键;不仅可以形成碳链,还可以形成碳环。
(3)分子式相同结构不同的化合物互为同分异构体,上图中互为同分异构体的是:丁烷与异丁烷;2-丁烯与1-丁烯、2-甲基-1-丙烯、环丁烷;2-丁炔与环丁烷。
(4)图中C物质是异丁烷,结构简式为CH(CH3)3。


科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种高效的多功能水处理剂,具有强氧化性。制备高铁酸钾方法很多。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为_____________________。
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:
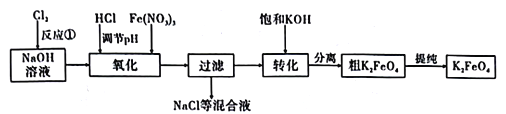
①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)_____S(Na2FeO4)(填“>”“<”或“=”)。
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为_________℃,此时Fe(NO3)3与NaClO 两种溶液最佳质量浓度之比为______________。

③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:_____________________。若Fe( NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为__________________________________。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__________溶液(填序号)。
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有_______________________。
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为_____________________。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中进行反应H2![]() 2H,若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反应时间应为
2H,若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反应时间应为
A. 等于10s B. 等于12s C. 大于12s D. 小于12s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒或物质:
A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 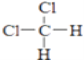 和
和 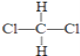
E、CH3CH2CH2CH3和 ![]()
(1)________组两种微粒互为同位素;
(2)________组两种物质互为同素异形体;
(3)________组两种物质属于烃;
(4)________组两物质互为同分异构体;
(5)________组两物质是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列说法错误的是( )
A.常温常压下,1 mol氦气含有的核外电子数为2NA
B.1.7gCH5+离子中含有的电子总数为NA
C.1molC10H22分子中共价键总数为31 NA
D.1molNO2与足量水反应时共转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是短周期中原子序数依次增大的四种元素。X可以分别与Y、Z、W 结合生成甲、乙、丙三种相同质子数的分子;相关物质之间的转化关系如图所示,已知丁是无色气体,遇空气显红棕色。下列说法正确的是
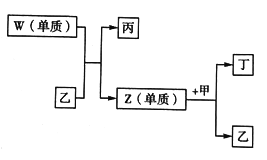
A. 原子半径的大小:W>X>Y>Z B. 单质的稳定性:X>Y>Z>W
C. 简单氢化物的沸点:Y>Z>W D. X 与Y、Z 均可形成原子个数比为2: 1的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4 Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
A.(I)中会生成BaSO3、BaSO4两种沉淀
B.可将(I)中的BaCl2溶液改为Ba(NO3)2溶液
C.(III)的作用是检验生成的SO2气体
D.(II)所盛x应为品红溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水逐步稀释0.2 mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-) B.c(NH4+) C.c(NH3·H2O) D.c(NH4+)/c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com