
下列各组物质互为同系物的是
A. C6H5OH和C6H5CH2OH B. CH3OH和HOCH2CH2OH
C. HCOOH和C17H35COOH D. CH3Cl和CH2Cl2
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液不呈血红色 | 稀HNO3不能将Fe氧化为Fe3+ |
| B | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和AgNO3溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究一溴环己烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三名同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
则有关上述实验方案叙述( )
A、甲正确 B、 乙正确 C、 丙正确 D、上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C10H20O2有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有( )
A、2种 B、3种 C、4种 D、5种
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物结构简式为: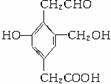 ,则用Na、NaOH、NaHCO3与等物质的量的该有机物恰好反应时,消耗Na、NaOH、NaHCO3的物质的量之比为
,则用Na、NaOH、NaHCO3与等物质的量的该有机物恰好反应时,消耗Na、NaOH、NaHCO3的物质的量之比为
A.3∶3∶2 B.3∶2∶1
C.1∶1∶1 D.3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下:
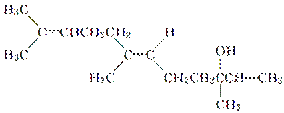
下列关于橙花醇的叙述,错误的是( )
A.既能发生取代反应,也能发生加成反应
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D.1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g溴
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为含苯环的化合物,且相对分子质量B>A>C,已知有机物A的结构简式为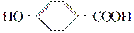 。
。
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式___________________________________。
(2)有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯(如下图)则有机物B的结构简式为____________。等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为________。
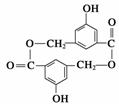
(3)D和B互为同分异构体,且知苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量比为2∶3,则D的结构简式为________________。(只写一种即可)
(4)1 mol A、C完全燃烧,消耗O2的质量相等,且1 mol C能和1 mol Na完全反应,写出含碳原子数最少的C的结构简式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
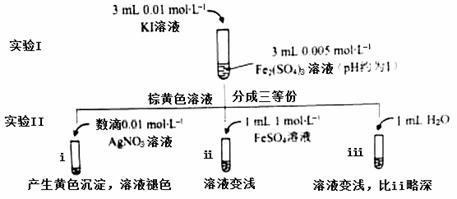
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。

①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com