
分析 (1)加入稀硝酸无气体放出,说明原溶液中无CO32-;
(2)加入一定量Ba(OH)2溶液,生成有色沉淀,该沉淀为Fe(OH)3,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成,该沉淀为AgCl;
(3)有色沉淀加入足量的稀盐酸后,沉淀全部溶解,说明沉淀中不含有硫酸钡;
(5)往得到的沉淀中加入过量的NaOH溶液,沉淀减少,说明原溶液中含有Al3+,此为Al(OH)3与碱的反应.
解答 解:(1)加入稀硝酸无气体放出,说明原溶液中无CO32-;
(2)加入一定量Ba(OH)2溶液,生成有色沉淀,说明原溶液中含有Fe3+,可能含有SO42-,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成,说明原溶液中含有Cl-;
(3)有色沉淀加入足量的稀盐酸后,沉淀全部溶解,说明沉淀中不含有硫酸钡,即原溶液中不存在SO42-;
(5)加入氨水使溶液呈碱性,有沉淀生成,过滤,往得到的沉淀中加入过量的NaOH溶液,沉淀减少,说明原溶液中肯定含有Fe3+、Al3+;
因此,一定不含有的离子是SO42-、CO32-;肯定含有的离子是Fe3+、Al3+、Cl-;因实验没有涉及到K+,则不能确定是否含有的离子是K+,可通过焰色反应进行鉴别,(5)中为铝离子与氨水反应生成氢氧化铝沉淀,离子反应方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,铁离子与氨水反应生成氢氧化铁沉淀,离子反应方程式为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,往沉淀中滴加氢氧化钠溶液,氢氧化铝溶于强碱,即氢氧化铝与氢氧化钠反应生成偏铝酸钠,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O,
因此,一定不含有的离子是SO42-、CO32-;肯定含有的离子是Fe3+、Al3+、Cl-;因实验没有涉及到K+,则不能确定是否含有的离子是K+,可通过焰色反应进行鉴别.
故答案为:SO42-、CO32-;Fe3+、Al3+、Cl-;K+;焰色反应.
点评 本题考查常见离子的检验,为高频考点,侧重于学生的分析、实验能力的考查,题目难度中等,本题注意通过反应的实验现象判断,把握物质的典型性质,作为推断的突破口.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O═2NaOH | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 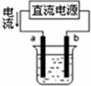 用如图装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 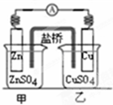 如图装置的盐桥中KCl的Cl-移向乙烧杯 | |
| C. |  如图装置中钢闸门应与外接电源的负极相连获得保护 | |
| D. | 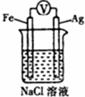 装置中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气在雷电作用下所产生NO | |
| B. | NO和O2生成NO2 | |
| C. | NH4Cl与Ca(OH)2反应生成NH3 | |
| D. | 在加压降温的条件下使空气中的氮气液化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
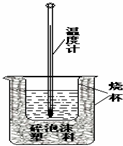 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示. | 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.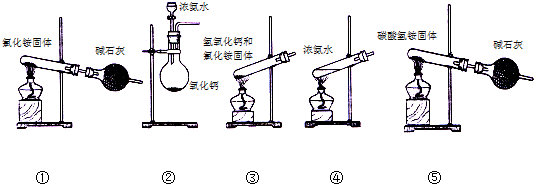
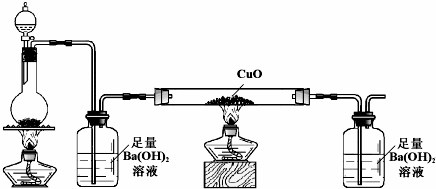
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾的相对原子质量较大 | |
| B. | 钾的密度比钠小 | |
| C. | 钾的原子半径大,失去电子的能力强 | |
| D. | 钾比钠与水反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、Na2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、K2SO4、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com